�V�K�L���̓��e���s�����ƂŁA��\���ɂ��邱�Ƃ��\�ł��B
�L��
�V�K�L���̓��e���s�����ƂŁA��\���ɂ��邱�Ƃ��\�ł��B
posted by fanblog
2023�N03��28��
Alchemy of Actor Biochemistry 03 icon of chemistry periodic table �����\
Alchemy of Actor Biochemistry 03 icon of chemistry periodic table �����\
���q�ԍ�atomic number �j�� nuclide ����ʂ���ʂ̈�Ō��q�j atomic nucleus �̒��ɂ���z�q�̌� �B
�d�ׂ�ттĂ��Ȃ��������q�́A���q���̓d�q�̐��ɓ������B
�L�� Z(�ƌ�Zahl �u��,�ԍ��v)�ŕ\�L�B
���݁A���f�̐������̂����肵�Ă���ő�̌��q�ԍ���Og. Oganesson �I�K�l�\����118�B
���q�ԍ��͌��f�̎�ނƑΉ��A�ʏ폑�����Ƃ͂Ȃ����A��������ꍇ�͌��f�L���̍��ɉ��t���Y�����ŏ����Bi.g. �Y�f carbon ; 6C
�j�� nuclide/nuclear species�Ƃ́A
���q�j�̑g���A(�j���̗z�q�̐��A�����q�̐� �j�̃G�l���M�[����)�ɂ���ċK�肳���
����̌��q�̎�ނ������B
�j��͌��q�j�̓��ʑ̂₻�̑��̐�������ʂ��邽�߂ɗ��p�����B
���˔\�����j�����ː��j��A�����ł͂Ȃ����肵���j�������j��ƌĂԁB
���q�j�̒��̗z�q�̐��͌��q�ԍ� Z �ŕ\���@���f�̉��w�I���������肷�B
�܂����q�j�̒��̊j�q�i�z�q�A�����q�̑��́j�̑����i�����q�̐��{�z�q�̐��j��
mass number ���ʐ� A �ƌĂ�A����͌X�̌��q�̌��q�ʂɍł��߂������ƂȂ�B
�����q�� N �� N = A - Z �ŋ��߂�B
�j��nuclide��\������L���́A���f�̉��w�L���ɑ����q�ԍ��������A���ʐ��������ɕt���B
i.g. ���f hydrogen . 1H �̓��ʑ́A���ʐ� 2 �̓�d���f deuterium �A
���{��Ŋj��́A���f���̌��Ɏ��ʐ���Y���� i.g.���f2�A�_�f16�A�Y�f12�B
�p��ł� Helium-4 �B
���q�j�̃G�l���M�[���ʂ̕\�L�@
���q�j�ɂ͗l�X�ȃG�l���M�[���ʂ���A
����łȂ���Ԃł͒ʏ�1�b�ɂ������Ȃ��ɂ߂ĒZ���������ŃK���}���A
�܂�ɔ�������������Ԃ����݂��B
���̃G�l���M�[��Ԃ̈قȂ����܂��͏������Ԃ̎����j�ِ��̂Ƃ����A
�����͕ʂ̊j��ł���Ɩ��m�ɋ�ʁB
i.g.�L�f35�͔�����18���Ńx�[�^���A
������4.4���Ԃ����������Ԃ̏L�f35�������݁A��҂��j�ِ��̂ł���O�҂Ƃ͕ʕ��Ƌ�ʁB
���������Z�����̂͒ʏ킻�̂܂ܕ\�L����邪�A
�������������̂�metastable�������Ԃ́j�Ƃ����Ӗ�����"m"�Ƃ������������ʐ��̂��Ƃɕt���ĕ\�L���Ai.g.�e�N�l�`�E�� technetium 43Tc ��99m�� �ƕ\�L�B
�j�ِ��̂�3�ȏ゠��Ƃ��́A�������Z�����̂��珇��m1�Am2�Am3���t���B
���R�E�ɂ͖�300�̊j��̑��݂��m���Ă���A
���̂�����270�킪���˔\ Radioactivity �������Ȃ����肵���j��Ŏc���30��ނ����ː��j��B
���˔\�����j��ł�����ː��j��̕����� Decay product �͕��ː��� radiogenic nuclide �j��ƌĂԁB
�V�R�̕��ː��j��ɂ�3�̎�ނ�����B
��1�́A������ half-life �iT1/2�j�����Ȃ��Ƃ��n���̔N��i��46���N�j��10%�ɒB������́B
�����͑��z�n�̌`���ȑO�̍P���ɂĐ��������q�j���� Nucleosynthesis �̎c�肩���B
i.g. U.uran �E����238�iT1/2=4.5×109 y�j�A�E����235�iT1/2=0.7×109 y�j�Ȃǂ��V�R�ɑ��݂��A
�E����235�́A�E����238�ɑ���138�{���H���B
��2��Ra. radium ���W�E��226 (T1/2=1602 y) �B
�����̓E����238�A�E����235��Tr. thorium �g���E��232�Ȃǂ�
��1�̃O���[�v�̕��ː�����̘A���ɂ��`�������B
��3�͒Y�f14�Ƃ������j��A�ʂ̊j�킩��F�����ɂ��j�j�� cosmic ray spallation �ɂ�萶���B
�j�����⌴�q�F�ȂǂŐl�H�I�ɐ����\�ł���j���2000��ވȏ�m���Ă���A
���_�㑶�݂��\�z����Ă�����̂��܂߂�Ƃ��̐��͖�6000��ނɂ��B
�Ɓ@���̂��������̓��X
���q�ԍ�atomic number �j�� nuclide ����ʂ���ʂ̈�Ō��q�j atomic nucleus �̒��ɂ���z�q�̌� �B
�d�ׂ�ттĂ��Ȃ��������q�́A���q���̓d�q�̐��ɓ������B
�L�� Z(�ƌ�Zahl �u��,�ԍ��v)�ŕ\�L�B
���݁A���f�̐������̂����肵�Ă���ő�̌��q�ԍ���Og. Oganesson �I�K�l�\����118�B
���q�ԍ��͌��f�̎�ނƑΉ��A�ʏ폑�����Ƃ͂Ȃ����A��������ꍇ�͌��f�L���̍��ɉ��t���Y�����ŏ����Bi.g. �Y�f carbon ; 6C
�j�� nuclide/nuclear species�Ƃ́A
���q�j�̑g���A(�j���̗z�q�̐��A�����q�̐� �j�̃G�l���M�[����)�ɂ���ċK�肳���
����̌��q�̎�ނ������B
�j��͌��q�j�̓��ʑ̂₻�̑��̐�������ʂ��邽�߂ɗ��p�����B
���˔\�����j�����ː��j��A�����ł͂Ȃ����肵���j�������j��ƌĂԁB
���q�j�̒��̗z�q�̐��͌��q�ԍ� Z �ŕ\���@���f�̉��w�I���������肷�B
�܂����q�j�̒��̊j�q�i�z�q�A�����q�̑��́j�̑����i�����q�̐��{�z�q�̐��j��
mass number ���ʐ� A �ƌĂ�A����͌X�̌��q�̌��q�ʂɍł��߂������ƂȂ�B
�����q�� N �� N = A - Z �ŋ��߂�B
�j��nuclide��\������L���́A���f�̉��w�L���ɑ����q�ԍ��������A���ʐ��������ɕt���B
i.g. ���f hydrogen . 1H �̓��ʑ́A���ʐ� 2 �̓�d���f deuterium �A
���{��Ŋj��́A���f���̌��Ɏ��ʐ���Y���� i.g.���f2�A�_�f16�A�Y�f12�B
�p��ł� Helium-4 �B
���q�j�̃G�l���M�[���ʂ̕\�L�@
���q�j�ɂ͗l�X�ȃG�l���M�[���ʂ���A
����łȂ���Ԃł͒ʏ�1�b�ɂ������Ȃ��ɂ߂ĒZ���������ŃK���}���A
�܂�ɔ�������������Ԃ����݂��B
���̃G�l���M�[��Ԃ̈قȂ����܂��͏������Ԃ̎����j�ِ��̂Ƃ����A
�����͕ʂ̊j��ł���Ɩ��m�ɋ�ʁB
i.g.�L�f35�͔�����18���Ńx�[�^���A
������4.4���Ԃ����������Ԃ̏L�f35�������݁A��҂��j�ِ��̂ł���O�҂Ƃ͕ʕ��Ƌ�ʁB
���������Z�����̂͒ʏ킻�̂܂ܕ\�L����邪�A
�������������̂�metastable�������Ԃ́j�Ƃ����Ӗ�����"m"�Ƃ������������ʐ��̂��Ƃɕt���ĕ\�L���Ai.g.�e�N�l�`�E�� technetium 43Tc ��99m�� �ƕ\�L�B
�j�ِ��̂�3�ȏ゠��Ƃ��́A�������Z�����̂��珇��m1�Am2�Am3���t���B
���R�E�ɂ͖�300�̊j��̑��݂��m���Ă���A
���̂�����270�킪���˔\ Radioactivity �������Ȃ����肵���j��Ŏc���30��ނ����ː��j��B
���˔\�����j��ł�����ː��j��̕����� Decay product �͕��ː��� radiogenic nuclide �j��ƌĂԁB
�V�R�̕��ː��j��ɂ�3�̎�ނ�����B
��1�́A������ half-life �iT1/2�j�����Ȃ��Ƃ��n���̔N��i��46���N�j��10%�ɒB������́B
�����͑��z�n�̌`���ȑO�̍P���ɂĐ��������q�j���� Nucleosynthesis �̎c�肩���B
i.g. U.uran �E����238�iT1/2=4.5×109 y�j�A�E����235�iT1/2=0.7×109 y�j�Ȃǂ��V�R�ɑ��݂��A
�E����235�́A�E����238�ɑ���138�{���H���B
��2��Ra. radium ���W�E��226 (T1/2=1602 y) �B
�����̓E����238�A�E����235��Tr. thorium �g���E��232�Ȃǂ�
��1�̃O���[�v�̕��ː�����̘A���ɂ��`�������B
��3�͒Y�f14�Ƃ������j��A�ʂ̊j�킩��F�����ɂ��j�j�� cosmic ray spallation �ɂ�萶���B
�j�����⌴�q�F�ȂǂŐl�H�I�ɐ����\�ł���j���2000��ވȏ�m���Ă���A
���_�㑶�݂��\�z����Ă�����̂��܂߂�Ƃ��̐��͖�6000��ނɂ��B
�Ɓ@���̂��������̓��X
�y���̃J�e�S���[�̍ŐV�L���z
-
no image
-
no image
-
no image
-
no image
-
no image
posted by ���������� at 15:39| �G���^�[�e�C�����g
2023�N03��06��
Alchemy of Actor Biochemistry 02 �����\icon of chemistry
Alchemy of Actor Biochemistry 02 icon of chemistry periodic table �����\
�����\�͌����I�ɁA���ォ�猴�q�ԍ��̏��ɕ��Ԃ悤�쐬�����B
�����\��Ō��f�͂��̌��q�̓d�q�z�u�ɏ]���ĕ��ׂ��A���������̌��f���K���I�ɏo�����B
�����\�̔z��́A���q�̒��S�Ɉʒu����j���ێ�����z�q�̌��Ɋ�Â��ĕt�����錴�q�ԍ����ɕ��ԁB
�z�q��1�ł��鐅�f����n�܂�A1�}�X�i�ނ��Ƃɗz�q��1�������f�L���������Ȃ�����ԁB
�������ɉ����ĉ��s����A2�i�ځE3�i�ځc�Ə����lj��B
���̂��߁A������E�ցA�܂��ォ�牺�֍s���ɂ�Č��q�ԍ����傫�Ȍ��f�����ԁB
���q�ɂ͗z�q���i���q�ԍ��j�Ɠ������̓d�q������A���ꂪ�z�q�j�̂܂��ɓd�q�k�w���`�������݁B
���̊k�͕�������A�d�q�͊�{�I�ɓ������珇�Ԃɖ��܂��Ă䂭�B
�����āA�ł��O���ɂ���d�q�i���d�q�j�͉��w�����Ȃǂ̕ω��ɂ����Ă��Ƃ肪���₷���A
���̌������f�̐��������߂�v���B
�Ƃ��낪�A�P���ɓd�q�k��������疄�߂Ă䂭�@���́A�A���S���i18�j�܂łɂ������Ă͂܂�Ȃ��B
���݂̂Ƃ���d�q�k��������߂��Ă���A��������K�EL�EM�EN�EO�EP�EQ�Ɩ��̂������B
���ꂼ��ɂ͎��܂�d�q�̍ő吔�����܂��Ă���A
K�k=2�AL=8�AM=18�AN=32�AO=50�B
����ɂ���́A�\�������Ɋ�Â��G�l���M�[���ʂɂ���ēd�q�����ɖ��܂�d�q�O���i���k�j�ɕ�������BK�k��2�̓d�q������1s�O���A
L�k��2�̓d�q������2s�O����6�̓d�q������2p�O���A�ȉ��A
M�k�i3s�O��=2�A3p�O��=6�A3d�O��=10�j�A
N�k�i4s=2�A4p=6�A4d=10�A4f=14�j�A
O�k�i5s=2�A5p=6�A5d=10�A5f=14�A�c�j�A
P�k�i6s=2�A6p=6�A�c�j�A
Q�k�i7s=2�A�c�j�B
���̂�����4�����ɂ����āA4s�O����3d�O��������ɓd�q�����������X���ł���B
���̂��߃J���E���i19�j����j�b�P���i28�j�܂ł�M�k�ɋ�Ȃ������Ԃ�
N�k��4s�O���ɓd�q���z�u����A���ꂪ�ŊO�k�Ƃ��Č��f�̐������`���B
�����āA�����\�̂ւ��������ɂ��邱�̌��f�Q�͕\�̉������ŋߎ������X��������A
�����ɊY������3–11���͑J�ڌ��f�A���̂悤�ȓ����͑�4�����ȍ~�̒������ƌĂ�镔���Ō���B
���̌��ۂ��N���闝�R�ɂ��āAM�k���̓d�q���m�����d�ׂŔ������邽�߂ɋN����Ɛ������B
����
���igroup/family�j
�����\�ɂ�����c�����̏W���B
���̑��͌��f�ނ����ōł��d�v�ȕ��@�ƍl�����Ă���B
�������̑��ɓ���e���f�̓����͔��Ɏ������A���q�ʂ������Ȃ�����Ŗ��炩�ȌX����������B
���̑����́A
�A���J�������ialkali metals�j�A
�A���J���y�ދ����ialkaline earth metals�j�A
�j�N�g�Q���ipnictogens�j�A
�J���R�Q���ichalcogens�j�A
�n���Q���ihalogens�j�A�M�K�X�inoble gases�j�B
��14�����f�Ȃǎ����\�ɂ����邻�̑��̑��͐��������ł̋ߎ��������܂茩��ꂸ�A
��{�I�ɑ��̐����ŕ\����邱�Ƃ������B
����̗ʎq�͊w���_���v�����錴�q�̍\���́A�������X���Ő�������A
�������Ƃɕ������ōł��d�v�ȗv�f�ɉe����^���錴�q���k�ɂ�����
�d�q�z�u������ł��錴�q�͓������Ɋ܂܂��B
�������̌��f�O���[�v�ɂ͌��q���a�E�C�I�����G�l���M�[�E�d�C�A���x�̌X���ɂ��ߎ�����������B
�ォ�牺�ɍs���ɂ�S�̂̃G�l���M�[�l�������Ȃ邽�߁A
���q���d�q�͌��q�j���牓���Ȃ��Ă䂫�A
���f�̌��q���a�͑傫���Ȃ�B
���q�S�̂��d�q��߂܂���͂͋����Ȃ邽�߁A
���ɍs���قǃC�I�����G�l���M�[�͏������Ȃ�A
���l�Ɍ��q�j�ƌ��q���d�q�̋����������Ȃ�ɂ�d�C�A���x���Ⴍ�Ȃ�B
����period
�����\�̂����鉡�����̏W���B
��{�I�Ɋe���f�̓����ɑ��Ŏ��������̎�����������͖����A
��O�I�ȉӏ��́A�J�ڋ����ƁA���Ƀ����^�m�C�h��A�N�`�m�C�h�ɂ����āA
���������ŋߎ��������������������B
���̎����́A�ŊO�d�q�k���������牽�Ԗڂł��邩��\���B
���������ɂ��錳�f��
���q���a�A�C�I�����G�l���M�[�A�d�q�e�a�́A�d�C�A���x�̃p�^�[���Ŏ����X���������B
������E�ɍs���ɂ�A��ʂɌ��q���a�͏������Ȃ�B
����́A���f�Ɋ܂܂��z�q�̐��͒i�X�Ƒ����A����ɉ����ēd�q�����q�j�ɂЂ������邽�߁B
����ɔ����ăC�I�����G�l���M�[�͑傫���Ȃ�A�M�K�X�ōő�B
���q���a���������Ȃ�ƑS�̂𑨂���͂����܂�A�d�q�����������ɕK�v�ȃG�l���M�[���傫���Ȃ�B
�d�C�A���x���������j�ɂ��d�q�̌����͂��������ߑ傫���Ȃ�B
�d�q�e�a�͂̎������ɂ��ω��X���͂킸���ł���B
�����\�����ɂ���������f�͈�ʂɁA�M�K�X�������ĉE���̔�������f�����d�q�e�a�͂͒Ⴂ�B
periodic table block�u���b�N
�ŊO�k�d�q�����f�̓����ɑ傫�ȉe����^����_���l�����Ď����\��̈�ŕ����镪�ށA
�u�Ō�̓d�q�v�����݂��鈟�k�̈ʒu�ɉ����Ė��̂����B
s�u���b�N���f�̓A���J�������ƃA���J���y�ދ����̂ӂ��̑��ɐ��f�ƃw���E���������u���b�N�B
p�u���b�N���f�͎c��6�̑��i13–18�����f�j���Y�����A�������͂����Ɋ܂ށB
d�u���b�N���f��3-12�����f�ɓ���J�ڋ������B
�ʏ�A�����\�̗��O�ɒu����郉���^�m�C�h�ƃA�N�`�m�C�h��f�u���b�N���f�B
���̑�
���f�͑��̏W���ł����ނ���A�����\�̏c���܂��̓u���b�N�ł������ɂ����ꍇ������B
�����E���������f�Ɣ�������f�̋敪�͈Î��I�ɂ����\������Ȃ��K�i��̎ߐ��ŋ�ʂ����B
���̐��̉E������������f�A�������������f�ŁA�Ԃɔ����������܂��B
���������T�^�I�����ł���d�q����o���₷�������́A�����\�̍����ŋ����Ȃ�B
�܂��A�P�̂��퉷�툳���Ŏ�镨���̏�ԁi�ő́E�t�́E�C�́j���u���b�N�ł͕\���ɂ����B
�S�̂̌X���͐��f�ƉE��̃w���E���t�߁i���f����E�A���f����E����ыM�K�X�j���C�̂ł���A
��O�I�ɉt�̂̑��ƂȂ�L�f�Ɛ���ƃt�����V�E�������������f�͌ő́B
���̂悤�ȕ��ނ́A�}�X�╶���F�Ȃǂ��ꂼ��̎����\�ōH�v�����炵���\���Ŏ������B
�Ɓ@���̂��������̓��X
�����\�͌����I�ɁA���ォ�猴�q�ԍ��̏��ɕ��Ԃ悤�쐬�����B
�����\��Ō��f�͂��̌��q�̓d�q�z�u�ɏ]���ĕ��ׂ��A���������̌��f���K���I�ɏo�����B
�����\�̔z��́A���q�̒��S�Ɉʒu����j���ێ�����z�q�̌��Ɋ�Â��ĕt�����錴�q�ԍ����ɕ��ԁB
�z�q��1�ł��鐅�f����n�܂�A1�}�X�i�ނ��Ƃɗz�q��1�������f�L���������Ȃ�����ԁB
�������ɉ����ĉ��s����A2�i�ځE3�i�ځc�Ə����lj��B
���̂��߁A������E�ցA�܂��ォ�牺�֍s���ɂ�Č��q�ԍ����傫�Ȍ��f�����ԁB
���q�ɂ͗z�q���i���q�ԍ��j�Ɠ������̓d�q������A���ꂪ�z�q�j�̂܂��ɓd�q�k�w���`�������݁B
���̊k�͕�������A�d�q�͊�{�I�ɓ������珇�Ԃɖ��܂��Ă䂭�B
�����āA�ł��O���ɂ���d�q�i���d�q�j�͉��w�����Ȃǂ̕ω��ɂ����Ă��Ƃ肪���₷���A
���̌������f�̐��������߂�v���B
�Ƃ��낪�A�P���ɓd�q�k��������疄�߂Ă䂭�@���́A�A���S���i18�j�܂łɂ������Ă͂܂�Ȃ��B
���݂̂Ƃ���d�q�k��������߂��Ă���A��������K�EL�EM�EN�EO�EP�EQ�Ɩ��̂������B
���ꂼ��ɂ͎��܂�d�q�̍ő吔�����܂��Ă���A
K�k=2�AL=8�AM=18�AN=32�AO=50�B
����ɂ���́A�\�������Ɋ�Â��G�l���M�[���ʂɂ���ēd�q�����ɖ��܂�d�q�O���i���k�j�ɕ�������BK�k��2�̓d�q������1s�O���A
L�k��2�̓d�q������2s�O����6�̓d�q������2p�O���A�ȉ��A
M�k�i3s�O��=2�A3p�O��=6�A3d�O��=10�j�A
N�k�i4s=2�A4p=6�A4d=10�A4f=14�j�A
O�k�i5s=2�A5p=6�A5d=10�A5f=14�A�c�j�A
P�k�i6s=2�A6p=6�A�c�j�A
Q�k�i7s=2�A�c�j�B
���̂�����4�����ɂ����āA4s�O����3d�O��������ɓd�q�����������X���ł���B
���̂��߃J���E���i19�j����j�b�P���i28�j�܂ł�M�k�ɋ�Ȃ������Ԃ�
N�k��4s�O���ɓd�q���z�u����A���ꂪ�ŊO�k�Ƃ��Č��f�̐������`���B
�����āA�����\�̂ւ��������ɂ��邱�̌��f�Q�͕\�̉������ŋߎ������X��������A
�����ɊY������3–11���͑J�ڌ��f�A���̂悤�ȓ����͑�4�����ȍ~�̒������ƌĂ�镔���Ō���B
���̌��ۂ��N���闝�R�ɂ��āAM�k���̓d�q���m�����d�ׂŔ������邽�߂ɋN����Ɛ������B
����
���igroup/family�j
�����\�ɂ�����c�����̏W���B
���̑��͌��f�ނ����ōł��d�v�ȕ��@�ƍl�����Ă���B
�������̑��ɓ���e���f�̓����͔��Ɏ������A���q�ʂ������Ȃ�����Ŗ��炩�ȌX����������B
���̑����́A
�A���J�������ialkali metals�j�A
�A���J���y�ދ����ialkaline earth metals�j�A
�j�N�g�Q���ipnictogens�j�A
�J���R�Q���ichalcogens�j�A
�n���Q���ihalogens�j�A�M�K�X�inoble gases�j�B
��14�����f�Ȃǎ����\�ɂ����邻�̑��̑��͐��������ł̋ߎ��������܂茩��ꂸ�A
��{�I�ɑ��̐����ŕ\����邱�Ƃ������B
����̗ʎq�͊w���_���v�����錴�q�̍\���́A�������X���Ő�������A
�������Ƃɕ������ōł��d�v�ȗv�f�ɉe����^���錴�q���k�ɂ�����
�d�q�z�u������ł��錴�q�͓������Ɋ܂܂��B
�������̌��f�O���[�v�ɂ͌��q���a�E�C�I�����G�l���M�[�E�d�C�A���x�̌X���ɂ��ߎ�����������B
�ォ�牺�ɍs���ɂ�S�̂̃G�l���M�[�l�������Ȃ邽�߁A
���q���d�q�͌��q�j���牓���Ȃ��Ă䂫�A
���f�̌��q���a�͑傫���Ȃ�B
���q�S�̂��d�q��߂܂���͂͋����Ȃ邽�߁A
���ɍs���قǃC�I�����G�l���M�[�͏������Ȃ�A
���l�Ɍ��q�j�ƌ��q���d�q�̋����������Ȃ�ɂ�d�C�A���x���Ⴍ�Ȃ�B
����period
�����\�̂����鉡�����̏W���B
��{�I�Ɋe���f�̓����ɑ��Ŏ��������̎�����������͖����A
��O�I�ȉӏ��́A�J�ڋ����ƁA���Ƀ����^�m�C�h��A�N�`�m�C�h�ɂ����āA
���������ŋߎ��������������������B
���̎����́A�ŊO�d�q�k���������牽�Ԗڂł��邩��\���B
���������ɂ��錳�f��
���q���a�A�C�I�����G�l���M�[�A�d�q�e�a�́A�d�C�A���x�̃p�^�[���Ŏ����X���������B
������E�ɍs���ɂ�A��ʂɌ��q���a�͏������Ȃ�B
����́A���f�Ɋ܂܂��z�q�̐��͒i�X�Ƒ����A����ɉ����ēd�q�����q�j�ɂЂ������邽�߁B
����ɔ����ăC�I�����G�l���M�[�͑傫���Ȃ�A�M�K�X�ōő�B
���q���a���������Ȃ�ƑS�̂𑨂���͂����܂�A�d�q�����������ɕK�v�ȃG�l���M�[���傫���Ȃ�B
�d�C�A���x���������j�ɂ��d�q�̌����͂��������ߑ傫���Ȃ�B
�d�q�e�a�͂̎������ɂ��ω��X���͂킸���ł���B
�����\�����ɂ���������f�͈�ʂɁA�M�K�X�������ĉE���̔�������f�����d�q�e�a�͂͒Ⴂ�B
periodic table block�u���b�N
�ŊO�k�d�q�����f�̓����ɑ傫�ȉe����^����_���l�����Ď����\��̈�ŕ����镪�ށA
�u�Ō�̓d�q�v�����݂��鈟�k�̈ʒu�ɉ����Ė��̂����B
s�u���b�N���f�̓A���J�������ƃA���J���y�ދ����̂ӂ��̑��ɐ��f�ƃw���E���������u���b�N�B
p�u���b�N���f�͎c��6�̑��i13–18�����f�j���Y�����A�������͂����Ɋ܂ށB
d�u���b�N���f��3-12�����f�ɓ���J�ڋ������B
�ʏ�A�����\�̗��O�ɒu����郉���^�m�C�h�ƃA�N�`�m�C�h��f�u���b�N���f�B
���̑�
���f�͑��̏W���ł����ނ���A�����\�̏c���܂��̓u���b�N�ł������ɂ����ꍇ������B
�����E���������f�Ɣ�������f�̋敪�͈Î��I�ɂ����\������Ȃ��K�i��̎ߐ��ŋ�ʂ����B
���̐��̉E������������f�A�������������f�ŁA�Ԃɔ����������܂��B
���������T�^�I�����ł���d�q����o���₷�������́A�����\�̍����ŋ����Ȃ�B
�܂��A�P�̂��퉷�툳���Ŏ�镨���̏�ԁi�ő́E�t�́E�C�́j���u���b�N�ł͕\���ɂ����B
�S�̂̌X���͐��f�ƉE��̃w���E���t�߁i���f����E�A���f����E����ыM�K�X�j���C�̂ł���A
��O�I�ɉt�̂̑��ƂȂ�L�f�Ɛ���ƃt�����V�E�������������f�͌ő́B
���̂悤�ȕ��ނ́A�}�X�╶���F�Ȃǂ��ꂼ��̎����\�ōH�v�����炵���\���Ŏ������B
�Ɓ@���̂��������̓��X
posted by ���������� at 16:18| �G���^�[�e�C�����g
2023�N03��02��
Alchemy of Actor Biochemistry �����w �O�P
Alchemy of Actor Biochemistry �����w �O�P
�����w�̌����́A�����w�ɓ��L�̋Z�p���g�p���邪�A
��������`�w�A���q�����w�A���������w�̕���ŊJ�����ꂽ�Z�p��l�����Ƒg�ݍ��킹��B
�����̕���̊Ԃɖ��m�ȋ��E���͂Ȃ��B
�����w�͕��q�̐����w�I�����ɕK�v�ȉ��w���������A
���q�����w�͕��q�̐����w�I�������������A
��`�w�̓Q�m�����S�����q�̈�`���ۂ���������B
�����w biochemistry�́A
���̓��ŋN���鉻�w�����Ɛ������ۂ��������B
�����w�́A���̕��q�̖����A�@�\�A����э\���ɏd�_��u���B
�����w�I�ߒ��̔w��ɂ��鉻�w�̌�����A�����w�I�Ɋ����ȕ��q�̍����́A�����w�̉��p�B
�����w�́A���q����ѕ��q�̃��x���ł̐����̌����B
��`�w genetics�́A
�����ɂ������`�I�ȍ��ق������炷�e�����������B
�����̏ꍇ�A����ȍ\���v�f�ie.g, �\����`�qstructural gene 1�� modifier gene �j�̌��@����
�������邱�Ƃ��ł���B
�ψّ�mutant ������쐶�^ WT,wild type ���邢�͐���ȕ\���^ phenotype �Ɣ�r����
1�������̋@�\�I�\���v�f�����������̌����B
��`�I���ݍ�p epistasis �́A
���̂悤�ȁu�m�b�N�A�E�g gene knockout �v�����̒P���ȉ��߂���������������B
���q�����wmolecular biology�́A
���q�̍����A�C���A�@�\�A����ё��ݍ�p�ɏœ_�Ă��A�������ۂ̕��q��Ղ���������B
��`������RNA�ɓ]�ʂ���A����Ƀ^���p�N�� protein �� �|���
�Ƃ������q�����w�̃Z���g�����h�O�} central dogma �́A�P�������ꂷ���Ă͂�����̂́A
���̕���𗝉����邽�߂̗ǂ��o���_�B
���̊T�O�́ARNA�̐V���Ȗ����̏o���ɂ���Č�������Ă���B
���w�����w chemical biology�́A
�����q small molecule �Ɋ�Â��V�����c�[�����J�����A
���̌n�ւ̉e�����ŏ����ɗ}���Ȃ���A���̋@�\�Ɋւ���ڍׂȏ�����邱�Ƃ�ڎw���B
����ɁA���w�����w�ł́A���̕��q�ƍ������u�Ƃ̔�V�R�n�C�u���b�h�����o�����߂�
���̃V�X�e���𗘗p�ie.g,,��`�q���Â��ܕ��q�𑗒B�ł����̃E�C���X�L���v�V�h virus-capsid;
�E�C���X�Q�m�������͂ރ^���p�N���̊k�̂��� �j�B
���������wbiophysics�j
�����V�X�e�����w�ƕ������w��p���ė������悤�Ǝ��݂�w�ۉȊw�B
���������w�́A���q�X�P�[�������́A�ʂĂ͐��Ԍn�܂ŁA�S�K�w�̐����w�I�g�D�������ΏۂƂ��B
�����w�A�i�m�e�N�m���W�[�A�����H�w�A�_�w�����w�A�V�X�e�������w�Ɩ��ڂɊW���A
�����̈�����L���邱�Ƃ������B
���q���������wMolecular biophysics�́A
�����w��������w�����������w�̖��Ɏ��g�ނ��A�������ɑ��Ē�ʓI�ȃA�v���[�`�����B
��זE���ɂ����邳�܂��܂ȃV�X�e���ie.g,RNA�������A�^���p�N���������Ȃǁj�̊ԂɋN����
���ݍ�p�̗����A����т���瑊�ݍ�p�̒��ߋ@�\�̗����ɒ��킷��B
�����Ă����̖����������߂ɁA���푽�l�Ȏ�����@���p������B
�Ɓ@���̂��������̓��X
�����w�̌����́A�����w�ɓ��L�̋Z�p���g�p���邪�A
��������`�w�A���q�����w�A���������w�̕���ŊJ�����ꂽ�Z�p��l�����Ƒg�ݍ��킹��B
�����̕���̊Ԃɖ��m�ȋ��E���͂Ȃ��B
�����w�͕��q�̐����w�I�����ɕK�v�ȉ��w���������A
���q�����w�͕��q�̐����w�I�������������A
��`�w�̓Q�m�����S�����q�̈�`���ۂ���������B
�����w biochemistry�́A
���̓��ŋN���鉻�w�����Ɛ������ۂ��������B
�����w�́A���̕��q�̖����A�@�\�A����э\���ɏd�_��u���B
�����w�I�ߒ��̔w��ɂ��鉻�w�̌�����A�����w�I�Ɋ����ȕ��q�̍����́A�����w�̉��p�B
�����w�́A���q����ѕ��q�̃��x���ł̐����̌����B
��`�w genetics�́A
�����ɂ������`�I�ȍ��ق������炷�e�����������B
�����̏ꍇ�A����ȍ\���v�f�ie.g, �\����`�qstructural gene 1�� modifier gene �j�̌��@����
�������邱�Ƃ��ł���B
�ψّ�mutant ������쐶�^ WT,wild type ���邢�͐���ȕ\���^ phenotype �Ɣ�r����
1�������̋@�\�I�\���v�f�����������̌����B
��`�I���ݍ�p epistasis �́A
���̂悤�ȁu�m�b�N�A�E�g gene knockout �v�����̒P���ȉ��߂���������������B
���q�����wmolecular biology�́A
���q�̍����A�C���A�@�\�A����ё��ݍ�p�ɏœ_�Ă��A�������ۂ̕��q��Ղ���������B
��`������RNA�ɓ]�ʂ���A����Ƀ^���p�N�� protein �� �|���
�Ƃ������q�����w�̃Z���g�����h�O�} central dogma �́A�P�������ꂷ���Ă͂�����̂́A
���̕���𗝉����邽�߂̗ǂ��o���_�B
���̊T�O�́ARNA�̐V���Ȗ����̏o���ɂ���Č�������Ă���B
���w�����w chemical biology�́A
�����q small molecule �Ɋ�Â��V�����c�[�����J�����A
���̌n�ւ̉e�����ŏ����ɗ}���Ȃ���A���̋@�\�Ɋւ���ڍׂȏ�����邱�Ƃ�ڎw���B
����ɁA���w�����w�ł́A���̕��q�ƍ������u�Ƃ̔�V�R�n�C�u���b�h�����o�����߂�
���̃V�X�e���𗘗p�ie.g,,��`�q���Â��ܕ��q�𑗒B�ł����̃E�C���X�L���v�V�h virus-capsid;
�E�C���X�Q�m�������͂ރ^���p�N���̊k�̂��� �j�B
���������wbiophysics�j
�����V�X�e�����w�ƕ������w��p���ė������悤�Ǝ��݂�w�ۉȊw�B
���������w�́A���q�X�P�[�������́A�ʂĂ͐��Ԍn�܂ŁA�S�K�w�̐����w�I�g�D�������ΏۂƂ��B
�����w�A�i�m�e�N�m���W�[�A�����H�w�A�_�w�����w�A�V�X�e�������w�Ɩ��ڂɊW���A
�����̈�����L���邱�Ƃ������B
���q���������wMolecular biophysics�́A
�����w��������w�����������w�̖��Ɏ��g�ނ��A�������ɑ��Ē�ʓI�ȃA�v���[�`�����B
��זE���ɂ����邳�܂��܂ȃV�X�e���ie.g,RNA�������A�^���p�N���������Ȃǁj�̊ԂɋN����
���ݍ�p�̗����A����т���瑊�ݍ�p�̒��ߋ@�\�̗����ɒ��킷��B
�����Ă����̖����������߂ɁA���푽�l�Ȏ�����@���p������B
�Ɓ@���̂��������̓��X
posted by ���������� at 15:13| �G���^�[�e�C�����g
2023�N02��13��
Alchemy of Actor Biochemistry �����w 00
Alchemy of Actor Biochemistry �����w 00
�̓��E�����Ɋ֘A���鉻�w�I�v���Z�X����������w��B
���w�Ɛ����w�̉��ʕ���ŁA�\�������w�A�y�f�w�A��ӊw��3�̕���ɕ�������B
20���I�Ō�̐��\�N�ԂŁA�����w�͂����̕����ʂ��A�������ۂ�������邱�Ƃɐ����B
�����Ȋw�̂قƂ�ǂ̕���́A�����w�I�ȕ��@�_�ƌ����ɂ��𖾂���A���W�B
�����w�́A�������זE����זE�ԂŐ��̕��q�ɋN����ߒ��ݏo�����w�I��Ղ������A
����ɂ��g�D��튯�A�����̍\���Ƌ@�\�����[����������B
�����w�́A�������ۂ̕��q�@�\���������镪�q�����w�Ƃ����ڂɊW�B
�����w�́A�^���p�N���A�j�_�A�Y�������A�����Ȃǂ�
���̍����q�̍\���A�����A�@�\�A�����đ��ݍ�p�������B
����番�q�́A�זE�̍\�������A�����@�\�̑����̖�����S���܂��A
�זE�̉��w�I�����́A�����q��C�I���̔����ɂ��ˑ���
����ɂ́A��������C�I���Ȃǂ̖��@����A
�^���p�N�������̂��߂̃A�~�m�_�Ȃǂ̗L�@�����܂܂��B
�זE���A���w�����ɂ���Ċ�����G�l���M�[�����o���@�\�́A��ӁB
���܂��܂Ȏ�ނ̐����w�I�Ȑ����ɂ́A��20��ނ̉��w���f���s���B
�n����̊��f�̑唼�i�Z�����ƃ��E�f�͏����j�͐����ɕK�v�ł͂Ȃ��A
�A���~�j�E����`�^���ȂǖL�x�ɑ��݂����ʓI�Ȍ��f�̒��ɂ́A�����ɗ��p����Ȃ����̂�����B
�قƂ�ǂ̐����͓����悤�Ȍ��f��K�v�Ƃ��邪�A�A���Ɠ����ɂ͎�̈Ⴂ������B
�A�C�m�����ނ͏L�f�𗘗p���邪�A����̓�����A���ɂ͕K�v�Ȃ��B
�i�g���E���͂��ׂĂ̓����ŕK�v�ł��邪�A�A���ɂ͕K�{�łȂ��B
�t�ɁA�A���ɂ̓P�C�f�ƃz�E�f���K�v�����A�����ɂ͕s�v���A���邢�͋ɔ��ʕK�v�B
�q�g���܂ސ��̍זE�̎��ʂ̂ق�99%���A
�Y�f�A���f�A���f�A�_�f�A�J���V�E���A�����̂킸��6���f����߂�@
�l�̂̑啔�����\�����邱���6��ނ̎�v���f�Ƃ͕ʂɁA
�q�g�͂����18��ވȏ�̌��f�����ʂ��K�v�Ƃ��B
Element
�@�@�@�@�@�@�@Symbol �@�@percent mass �@�@percent atoms
Oxygen �@�@�@O �@�@�@�@�@�@�@65.0 �@�@�@�@�@�@�@24.0
Carbon �@�@�@C �@�@�@�@�@�@�@18.5�@�@�@�@�@�@�@12.0
Hydrogen �@�@H �@�@�@�@�@�@�@10 �@�@�@�@�@�@�@62.0
Nitrogen �@�@�@N �@�@�@�@�@�@�@3.2 �@�@�@�@�@�@�@1.1
Calcium �@�@�@Ca �@�@�@�@�@�@1.5�@�@�@�@�@�@�@0.22
Phosphorus �@�@P �@�@�@�@�@�@1.0�@�@�@�@�@�@�@0.22
Potassium �@�@�@K�@�@�@�@�@�@0.4 �@�@�@�@�@�@�@0.03
Sulfur �@�@�@�@�@S�@�@�@�@�@�@0.3�@�@�@�@�@�@�@�@0.038
Sodium �@�@�@�@Na �@�@�@�@�@0.2�@�@�@�@�@�@�@�@0.037
Chlorine �@�@�@�@Cl �@�@�@�@�@�@0.2 �@�@�@�@�@�@�@0.024
Magnesium�@�@�@Mg �@�@�@�@�@�@0.1 �@�@�@�@�@�@�@0.015
All others �@�@�@�@�@�@�@�@�@�@�@�@�@< 0.1 �@�@�@�@�@< 0.3
�����w�ɂ�����4��ނ̎�v�ȕ��q�i���̕��q�j�́A�Y�������A�����A�^���p�N���A�j�_�B
�����̐��̕��q�̓|���}�[�i�d���́j�B
���m�}�[�i�P�ʑ́j�͔�r�I�����ȍ����q�ŁA
����炪�E�������ƌĂ��ߒ��Ō݂��Ɍ������A���̍����q�`���B�܂��A
���܂��܂ȍ����q���W�����āA���傫�ȕ����̂��`�����A����͐����w�I�����ɕK�v�B
�Ɓ@���̂��������̓��X
�̓��E�����Ɋ֘A���鉻�w�I�v���Z�X����������w��B
���w�Ɛ����w�̉��ʕ���ŁA�\�������w�A�y�f�w�A��ӊw��3�̕���ɕ�������B
20���I�Ō�̐��\�N�ԂŁA�����w�͂����̕����ʂ��A�������ۂ�������邱�Ƃɐ����B
�����Ȋw�̂قƂ�ǂ̕���́A�����w�I�ȕ��@�_�ƌ����ɂ��𖾂���A���W�B
�����w�́A�������זE����זE�ԂŐ��̕��q�ɋN����ߒ��ݏo�����w�I��Ղ������A
����ɂ��g�D��튯�A�����̍\���Ƌ@�\�����[����������B
�����w�́A�������ۂ̕��q�@�\���������镪�q�����w�Ƃ����ڂɊW�B
�����w�́A�^���p�N���A�j�_�A�Y�������A�����Ȃǂ�
���̍����q�̍\���A�����A�@�\�A�����đ��ݍ�p�������B
����番�q�́A�זE�̍\�������A�����@�\�̑����̖�����S���܂��A
�זE�̉��w�I�����́A�����q��C�I���̔����ɂ��ˑ���
����ɂ́A��������C�I���Ȃǂ̖��@����A
�^���p�N�������̂��߂̃A�~�m�_�Ȃǂ̗L�@�����܂܂��B
�זE���A���w�����ɂ���Ċ�����G�l���M�[�����o���@�\�́A��ӁB
���܂��܂Ȏ�ނ̐����w�I�Ȑ����ɂ́A��20��ނ̉��w���f���s���B
�n����̊��f�̑唼�i�Z�����ƃ��E�f�͏����j�͐����ɕK�v�ł͂Ȃ��A
�A���~�j�E����`�^���ȂǖL�x�ɑ��݂����ʓI�Ȍ��f�̒��ɂ́A�����ɗ��p����Ȃ����̂�����B
�قƂ�ǂ̐����͓����悤�Ȍ��f��K�v�Ƃ��邪�A�A���Ɠ����ɂ͎�̈Ⴂ������B
�A�C�m�����ނ͏L�f�𗘗p���邪�A����̓�����A���ɂ͕K�v�Ȃ��B
�i�g���E���͂��ׂĂ̓����ŕK�v�ł��邪�A�A���ɂ͕K�{�łȂ��B
�t�ɁA�A���ɂ̓P�C�f�ƃz�E�f���K�v�����A�����ɂ͕s�v���A���邢�͋ɔ��ʕK�v�B
�q�g���܂ސ��̍זE�̎��ʂ̂ق�99%���A
�Y�f�A���f�A���f�A�_�f�A�J���V�E���A�����̂킸��6���f����߂�@
�l�̂̑啔�����\�����邱���6��ނ̎�v���f�Ƃ͕ʂɁA
�q�g�͂����18��ވȏ�̌��f�����ʂ��K�v�Ƃ��B
Element
�@�@�@�@�@�@�@Symbol �@�@percent mass �@�@percent atoms
Oxygen �@�@�@O �@�@�@�@�@�@�@65.0 �@�@�@�@�@�@�@24.0
Carbon �@�@�@C �@�@�@�@�@�@�@18.5�@�@�@�@�@�@�@12.0
Hydrogen �@�@H �@�@�@�@�@�@�@10 �@�@�@�@�@�@�@62.0
Nitrogen �@�@�@N �@�@�@�@�@�@�@3.2 �@�@�@�@�@�@�@1.1
Calcium �@�@�@Ca �@�@�@�@�@�@1.5�@�@�@�@�@�@�@0.22
Phosphorus �@�@P �@�@�@�@�@�@1.0�@�@�@�@�@�@�@0.22
Potassium �@�@�@K�@�@�@�@�@�@0.4 �@�@�@�@�@�@�@0.03
Sulfur �@�@�@�@�@S�@�@�@�@�@�@0.3�@�@�@�@�@�@�@�@0.038
Sodium �@�@�@�@Na �@�@�@�@�@0.2�@�@�@�@�@�@�@�@0.037
Chlorine �@�@�@�@Cl �@�@�@�@�@�@0.2 �@�@�@�@�@�@�@0.024
Magnesium�@�@�@Mg �@�@�@�@�@�@0.1 �@�@�@�@�@�@�@0.015
All others �@�@�@�@�@�@�@�@�@�@�@�@�@< 0.1 �@�@�@�@�@< 0.3
�����w�ɂ�����4��ނ̎�v�ȕ��q�i���̕��q�j�́A�Y�������A�����A�^���p�N���A�j�_�B
�����̐��̕��q�̓|���}�[�i�d���́j�B
���m�}�[�i�P�ʑ́j�͔�r�I�����ȍ����q�ŁA
����炪�E�������ƌĂ��ߒ��Ō݂��Ɍ������A���̍����q�`���B�܂��A
���܂��܂ȍ����q���W�����āA���傫�ȕ����̂��`�����A����͐����w�I�����ɕK�v�B
�Ɓ@���̂��������̓��X
posted by ���������� at 14:12| �G���^�[�e�C�����g
2023�N02��12��
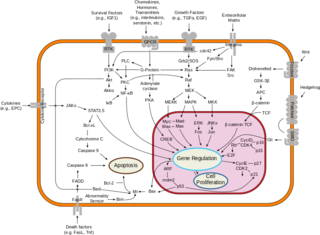
Alchemy of Actor Signal transduction�V�O�i���`�B 05
Alchemy of Actor Signal transduction 05
�CG�^���p�N�������^��e�́iGi�j�E�E�E�A�Z�`���R������e�́iM2�AM4�j
�O�ʑ�G�^���p�N���ɂ�G���̈Ⴂ�ɂ���đ傫��������Gs�AGi�AGq��3��ނ���B
Gs�̓A�f�j���_�V�N���[�[������������^�C�v�A
Gi�̓A�f�j���_�V�N���[�[��}������^�C�v�A
Gq��PLC�i�z�X�z���p�[�[C�j������������^�C�v�B
�A�Z�`���R������e�̂ɂ́A
�C�I���`���l�����̎�e�̂� G�^���p�N�������^��e�̂̂Q��ނ���B
���X�J�������A�Z�`���R������e�� (G�^���p�N�������^�̃A�Z�`���R������e�̂̂���)�A
M1~M5�̂T��ނ���B
���̂����AM2��M4��Gi�Ƌ������Ă���G�^���p�N�������^��e�́iGi�j�B
���̂��߁A�A�Z�`���R������
7�ђʌ^��G�^���p�N�������^��e��
���X�J�������A�Z�`���R������e�́iM2���邢��M4�j�Ɍ�������ƁA�A�f�j���_�V�N���[�[���}���B
�E���X�J�������A�Z�`���R������e�́iM2��M4�j��Gi�Ƌ������Ă���G�^���p�N�������^��e�́iGi�j
�EG��i�̓A�f�j���_�V�N���[�[��}�����A�זE����cAMP�Z�x������������
�DG�^���p�N�������^��e�́iGq�j�E�E�E�A�Z�`���R������e�́iM1�AM3�AM5
G�^���p�N�������^�̃A�Z�`���R������e�̂̂����A
M1��M3��M5��Gq�Ƌ������Ă���G�^���p�N�������^��e�́iGq�j�B
���̂��߁A�A�Z�`���R������
7�ђʌ^��G�^���p�N�������^��e�̃��X�J�������A�Z�`���R������e�́iM1,M3.M5�j�Ɍ�������ƁA
�z�X�z���p�[�[C�iPLC�j���������A
�z�X�t�@�`�W���C�m�V�g�[��4,5-�r�X�����_�iPIP2�j���A
�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�F�C�m�V�g�[��1,4,5-�O�����_�j���Y���B
�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�j�̓Z�J���h���b�Z���W���[�Ƃ��ē����A
�W�A�V���O���Z���[���iDG�j�͍זE����Ńv���e�C���L�i�[�[C�iPKC�j���������B����A
�C�m�V�g�[���R�����_�iIP3�j�͏��E�̂����Ca2�{�̕��o�𑣐i�A
�v���e�C���L�i�[�[C�iPKC�j���������A
�J�����W������/Ca2�{�����^���p�N�������
�J�����W�������ˑ����v���e�C���L�i�[�[�iCaM�L�i�[�[�j���������B
�E���X�J�������A�Z�`���R������e�́iM1,M3,M5�j��
Gq�Ƌ������Ă���G�^���p�N�������^��e�́iGq�j
�EG��q�̓z�X�z���p�[�[C�iPLC�j�����������A
�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�j���Y��
�Ɓ@���̂��������̓��X
�CG�^���p�N�������^��e�́iGi�j�E�E�E�A�Z�`���R������e�́iM2�AM4�j
�O�ʑ�G�^���p�N���ɂ�G���̈Ⴂ�ɂ���đ傫��������Gs�AGi�AGq��3��ނ���B
Gs�̓A�f�j���_�V�N���[�[������������^�C�v�A
Gi�̓A�f�j���_�V�N���[�[��}������^�C�v�A
Gq��PLC�i�z�X�z���p�[�[C�j������������^�C�v�B
�A�Z�`���R������e�̂ɂ́A
�C�I���`���l�����̎�e�̂� G�^���p�N�������^��e�̂̂Q��ނ���B
���X�J�������A�Z�`���R������e�� (G�^���p�N�������^�̃A�Z�`���R������e�̂̂���)�A
M1~M5�̂T��ނ���B
���̂����AM2��M4��Gi�Ƌ������Ă���G�^���p�N�������^��e�́iGi�j�B
���̂��߁A�A�Z�`���R������
7�ђʌ^��G�^���p�N�������^��e��
���X�J�������A�Z�`���R������e�́iM2���邢��M4�j�Ɍ�������ƁA�A�f�j���_�V�N���[�[���}���B
�E���X�J�������A�Z�`���R������e�́iM2��M4�j��Gi�Ƌ������Ă���G�^���p�N�������^��e�́iGi�j
�EG��i�̓A�f�j���_�V�N���[�[��}�����A�זE����cAMP�Z�x������������
�DG�^���p�N�������^��e�́iGq�j�E�E�E�A�Z�`���R������e�́iM1�AM3�AM5
G�^���p�N�������^�̃A�Z�`���R������e�̂̂����A
M1��M3��M5��Gq�Ƌ������Ă���G�^���p�N�������^��e�́iGq�j�B
���̂��߁A�A�Z�`���R������
7�ђʌ^��G�^���p�N�������^��e�̃��X�J�������A�Z�`���R������e�́iM1,M3.M5�j�Ɍ�������ƁA
�z�X�z���p�[�[C�iPLC�j���������A
�z�X�t�@�`�W���C�m�V�g�[��4,5-�r�X�����_�iPIP2�j���A
�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�F�C�m�V�g�[��1,4,5-�O�����_�j���Y���B
�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�j�̓Z�J���h���b�Z���W���[�Ƃ��ē����A
�W�A�V���O���Z���[���iDG�j�͍זE����Ńv���e�C���L�i�[�[C�iPKC�j���������B����A
�C�m�V�g�[���R�����_�iIP3�j�͏��E�̂����Ca2�{�̕��o�𑣐i�A
�v���e�C���L�i�[�[C�iPKC�j���������A
�J�����W������/Ca2�{�����^���p�N�������
�J�����W�������ˑ����v���e�C���L�i�[�[�iCaM�L�i�[�[�j���������B
�E���X�J�������A�Z�`���R������e�́iM1,M3,M5�j��
Gq�Ƌ������Ă���G�^���p�N�������^��e�́iGq�j
�EG��q�̓z�X�z���p�[�[C�iPLC�j�����������A
�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�j���Y��
�Ɓ@���̂��������̓��X
posted by ���������� at 13:25| �G���^�[�e�C�����g
2023�N02��10��
Alchemy of Actor Signal transduction�V�O�i���`�B�@ 04
Alchemy of Actor Singlal trandsuction 04
�AEGF��FGF�Ȃǂ̎�e�́E�E�E�y�f�����^��e�́i�`���V���L�i�[�[�^��e�́j
MAPK�iMAP�L�i�[�[�j�̃����_���̘A������: MAP�L�i�[�[�J�X�P�[�h
EGF��FGF�Ȃǂ̐������q����e�̂Ɍ�������ƁA
���ȃ����_���ƃA�_�v�^�[�^���p�N���̃����_������A
GRB2��SOS�̕����̂������������B
SOS�͒ᕪ�q��G�^���p�N���ł���Ras�ɑ���GEF�Ƃ��č�p�ARas���������B
���������ꂽRas�́AMAPKKK�iMAP�L�i�[�[�L�i�[�[�L�i�[�[�j�ł���Raf�������_�����Ċ������B
���������ꂽRaf��MAPKK�iMAP�L�i�[�[�L�i�[�[�j�ł���MEK�������_�����Ċ������B
�����āA���������ꂽMEK��MAPK�iMAP�L�i�[�[�j�ł���ERK�������_�����Ċ������B
���̂悤�ɂ��āARas-Raf-MEK-ERK�̌o�H�iERK�o�H�j�������������B
MAP�L�i�[�[�J�X�P�[�h�ɂ́AERK�o�H�̑��ɂ�p38�o�H�AJNK�o�H�Ȃǂ�����B
����AEGF��FGF�Ȃǂ̎�e�̂�
�C���X������e�̂Ɠ����`���V���L�i�[�[�^�̎�e�̂Ȃ̂ŁAPI3K-Akt�o�H������������B
�BG�^���p�N�������^��e�́iGs�j�E�E�E�O���J�S����e��
�O���J�S����7�ђʌ^��G�^���p�N�������^��e�̂ł���O���J�S����e�̂Ɍ�������ƁA
��,��,���̎O�̃T�u���j�b�g���琬��G�^���p�N���̃��T�u���j�b�g����GDP���𗣂��A
GTP����������O�A�j���k�N���I�`�h�����������N����B����ɂ��G�^���p�N���͊������B
���̌�AGTP���������������^G�^���p�N���̓A�f�j���_�V�N���[�[���������A
���ꂪATP����cAMP�ւ̍����𑣐i�B
cAMP�̓Z�J���h���b�Z���W���[�Ƃ���PKA�i�v���e�C���L�i�[�[A�j���������B
PKA�Ƃ́AcAMP�ɂ���Ċ����������v���e�C���L�i�[�[�̂��ƁB
7�ђʌ^G�^���p�N�������^��e�̂ł���O���J�S����e�̂ɋ������Ă���G���T�u���j�b�g�́A
�A�f�j���_�V�N���[�[�����������זE��cAMP�Z�x���㏸�����邪�A
���̂悤�ɃA�f�j���_�V�N���[�[������������^�C�v��G�^���p�N��Gs�ƌĂԁB
�E�O���J�S����e�̂�Gs�Ƌ������Ă���G�^���p�N�������^��e�́iGs�j
�EG��s�̓A�f�j���_�V�N���[�[�����������A�זE����cAMP�Z�x���㏸
�EcAMP�̓Z�J���h���b�Z���W���[�Ƃ���PKA�����������V�O�i���`�B���s��
�Ɓ@���̂��������̓��X
�AEGF��FGF�Ȃǂ̎�e�́E�E�E�y�f�����^��e�́i�`���V���L�i�[�[�^��e�́j
MAPK�iMAP�L�i�[�[�j�̃����_���̘A������: MAP�L�i�[�[�J�X�P�[�h
EGF��FGF�Ȃǂ̐������q����e�̂Ɍ�������ƁA
���ȃ����_���ƃA�_�v�^�[�^���p�N���̃����_������A
GRB2��SOS�̕����̂������������B
SOS�͒ᕪ�q��G�^���p�N���ł���Ras�ɑ���GEF�Ƃ��č�p�ARas���������B
���������ꂽRas�́AMAPKKK�iMAP�L�i�[�[�L�i�[�[�L�i�[�[�j�ł���Raf�������_�����Ċ������B
���������ꂽRaf��MAPKK�iMAP�L�i�[�[�L�i�[�[�j�ł���MEK�������_�����Ċ������B
�����āA���������ꂽMEK��MAPK�iMAP�L�i�[�[�j�ł���ERK�������_�����Ċ������B
���̂悤�ɂ��āARas-Raf-MEK-ERK�̌o�H�iERK�o�H�j�������������B
MAP�L�i�[�[�J�X�P�[�h�ɂ́AERK�o�H�̑��ɂ�p38�o�H�AJNK�o�H�Ȃǂ�����B
����AEGF��FGF�Ȃǂ̎�e�̂�
�C���X������e�̂Ɠ����`���V���L�i�[�[�^�̎�e�̂Ȃ̂ŁAPI3K-Akt�o�H������������B
�BG�^���p�N�������^��e�́iGs�j�E�E�E�O���J�S����e��
�O���J�S����7�ђʌ^��G�^���p�N�������^��e�̂ł���O���J�S����e�̂Ɍ�������ƁA
��,��,���̎O�̃T�u���j�b�g���琬��G�^���p�N���̃��T�u���j�b�g����GDP���𗣂��A
GTP����������O�A�j���k�N���I�`�h�����������N����B����ɂ��G�^���p�N���͊������B
���̌�AGTP���������������^G�^���p�N���̓A�f�j���_�V�N���[�[���������A
���ꂪATP����cAMP�ւ̍����𑣐i�B
cAMP�̓Z�J���h���b�Z���W���[�Ƃ���PKA�i�v���e�C���L�i�[�[A�j���������B
PKA�Ƃ́AcAMP�ɂ���Ċ����������v���e�C���L�i�[�[�̂��ƁB
7�ђʌ^G�^���p�N�������^��e�̂ł���O���J�S����e�̂ɋ������Ă���G���T�u���j�b�g�́A
�A�f�j���_�V�N���[�[�����������זE��cAMP�Z�x���㏸�����邪�A
���̂悤�ɃA�f�j���_�V�N���[�[������������^�C�v��G�^���p�N��Gs�ƌĂԁB
�E�O���J�S����e�̂�Gs�Ƌ������Ă���G�^���p�N�������^��e�́iGs�j
�EG��s�̓A�f�j���_�V�N���[�[�����������A�זE����cAMP�Z�x���㏸
�EcAMP�̓Z�J���h���b�Z���W���[�Ƃ���PKA�����������V�O�i���`�B���s��
�Ɓ@���̂��������̓��X
posted by ���������� at 13:24| �G���^�[�e�C�����g
2023�N02��04��
Alchemy of Actor Singlal trandsuction�V�O�i���`�B 03
Alchemy of Actor Singlal trandsuction 03
��e�̂������\�I�ȃV�O�i���`�B�̗�
�@�C���X������e�́E�E�E�y�f�����^��e�́i�`���V���L�i�[�[�^��e�́j
�uPI3K/Akt�o�H�v�C���X�����̌o�H�@���̔����̍y�f�̖��O����B
�C���X�������C���X������e�̂Ɍ�������ƁA
�C���X������e�̂̓C���X������e�̂����`���V���L�i�[�[�����ɂ�莩�ȃ����_���B
����ɂ���ă`���V���L�i�[�[����������Ɋ���������A
���x�̓A�_�v�^�[�^���p�N���̈��IRS�iinsulin receptor substrate�j�������_���B
���Ƀ����_�����ꂽIRS��PI3�L�i�[�[�i�z�X�t�@�`�W���C�m�V�g�[���̂R�ʂ������_������y�f�j���������A�זE�����PIP2�i�z�X�t�@�`�W���C�m�V�g�[��2�����_�j��
PIP3�i�z�X�t�@�`�W���C�m�V�g�[��3�����_�j�ɕϊ��B
����PIP3�̓h�b�L���O�T�C�g�Ƃ��ăv���e�C���L�i�[�[B�iPKB�AAkt�j��
PDK1�i�z�X�t�@�`�W���C�m�V�g�[���ˑ����v���e�C���L�i�[�[�j���זE���ɌĂъ�B
���̌�A�זE���ɌĂъ�ꂽPKB�iAkt�j��PDK1�ɂ���ă����_������A
�����^PKB�i�����^Akt�j�ɕϊ��B
���̂悤�ɂ��Đ����������^PKB�i�����^Akt�j�͍זE���𗣂�Ă���ɉ����̃^���p�N���������_���B
Akt�̓����̈��mTORC1�imechanistic target of rapamycin complex1�j�̊���������B
���������ꂽAkt�͂܂��A
TSC2�iTuberous Sclerosis Complex 2�F���ߐ��d���Ǖ�����2�j�^���p�N���������_�����đj�Q�B
TSC2��
TSC1��TBC1D7�Ƃ̂R�ʑ̂���Ȃ镡���́iTSC�FTSC1-TSC2-TBC1D7�j���`�����Ă��邪�A
Akt�ɂ��TSC2�������_������邱�Ƃɂ���āA���\�\�[��������𗣁B
TSC�́A
mTORC1������������ᕪ�q��G�^���p�N��Rheb�ɑ���GTPase�������^���p�N��
�iGTPase- activating protein�FGAP�j�Ƃ��ē������ƂŁA
���i��mTORC1��j�Q�B
����A���������ꂽAkt��TSC2�������_������Rheb�̗}�������������ƁA
Rheb�ɂ����mTORC1�͊������B
���������ꂽmTORC1�́A
�W�I�^���p�N��S6K�i�����_�����ꂽS6K��40S���{�\�[���^���p�N��S6�̃����_������|��𑣐i�j��4EBP�i�����_�����ꂽ4EBP�͖|��J�n���qeIF4E����𗣂��|��𑣐i�j
�������_�����邱�Ƃɂ���āA�^���p�N�������i�|��j�𑣐i�B
�E�C���X������e�̂̓`���V���L�i�[�[�^��e��
�E�C���X������PI3K-Akt�o�H�����mTORC1��������
�EmTORC1��S6K��4EBP�������_�����Ė|��𑣐i
�Ɓ@���̂��������̓��X
��e�̂������\�I�ȃV�O�i���`�B�̗�
�@�C���X������e�́E�E�E�y�f�����^��e�́i�`���V���L�i�[�[�^��e�́j
�uPI3K/Akt�o�H�v�C���X�����̌o�H�@���̔����̍y�f�̖��O����B
�C���X�������C���X������e�̂Ɍ�������ƁA
�C���X������e�̂̓C���X������e�̂����`���V���L�i�[�[�����ɂ�莩�ȃ����_���B
����ɂ���ă`���V���L�i�[�[����������Ɋ���������A
���x�̓A�_�v�^�[�^���p�N���̈��IRS�iinsulin receptor substrate�j�������_���B
���Ƀ����_�����ꂽIRS��PI3�L�i�[�[�i�z�X�t�@�`�W���C�m�V�g�[���̂R�ʂ������_������y�f�j���������A�זE�����PIP2�i�z�X�t�@�`�W���C�m�V�g�[��2�����_�j��
PIP3�i�z�X�t�@�`�W���C�m�V�g�[��3�����_�j�ɕϊ��B
����PIP3�̓h�b�L���O�T�C�g�Ƃ��ăv���e�C���L�i�[�[B�iPKB�AAkt�j��
PDK1�i�z�X�t�@�`�W���C�m�V�g�[���ˑ����v���e�C���L�i�[�[�j���זE���ɌĂъ�B
���̌�A�זE���ɌĂъ�ꂽPKB�iAkt�j��PDK1�ɂ���ă����_������A
�����^PKB�i�����^Akt�j�ɕϊ��B
���̂悤�ɂ��Đ����������^PKB�i�����^Akt�j�͍זE���𗣂�Ă���ɉ����̃^���p�N���������_���B
Akt�̓����̈��mTORC1�imechanistic target of rapamycin complex1�j�̊���������B
���������ꂽAkt�͂܂��A
TSC2�iTuberous Sclerosis Complex 2�F���ߐ��d���Ǖ�����2�j�^���p�N���������_�����đj�Q�B
TSC2��
TSC1��TBC1D7�Ƃ̂R�ʑ̂���Ȃ镡���́iTSC�FTSC1-TSC2-TBC1D7�j���`�����Ă��邪�A
Akt�ɂ��TSC2�������_������邱�Ƃɂ���āA���\�\�[��������𗣁B
TSC�́A
mTORC1������������ᕪ�q��G�^���p�N��Rheb�ɑ���GTPase�������^���p�N��
�iGTPase- activating protein�FGAP�j�Ƃ��ē������ƂŁA
���i��mTORC1��j�Q�B
����A���������ꂽAkt��TSC2�������_������Rheb�̗}�������������ƁA
Rheb�ɂ����mTORC1�͊������B
���������ꂽmTORC1�́A
�W�I�^���p�N��S6K�i�����_�����ꂽS6K��40S���{�\�[���^���p�N��S6�̃����_������|��𑣐i�j��4EBP�i�����_�����ꂽ4EBP�͖|��J�n���qeIF4E����𗣂��|��𑣐i�j
�������_�����邱�Ƃɂ���āA�^���p�N�������i�|��j�𑣐i�B
�E�C���X������e�̂̓`���V���L�i�[�[�^��e��
�E�C���X������PI3K-Akt�o�H�����mTORC1��������
�EmTORC1��S6K��4EBP�������_�����Ė|��𑣐i
�Ɓ@���̂��������̓��X
posted by ���������� at 14:34| �G���^�[�e�C�����g
2023�N02��03��
Alchemy of Actor Signal transduction�V�O�i���`�B�@02
Alchemy of Actor Signal transduction02
�V�O�i���`�B�̎d�g�݂𗝉����邽�߂ɁA
�ǂ̂悤�ɂ��ăV�O�i�����q�����������ꂽ��s�����������̂���T��B
�V�O�i���`�B�̗l���A
�EG�^���p�N��guanine nucleotide-binding proteins, ������V�O�i���`�B
�E�����_��phosphorylation������V�O�i���`�B
�E�Z�J���h���b�Z���W���[Second messenger system������V�O�i���`�B
�yG�^���p�N���z
�Ƃ́AGTP�����^���p�N���̂��ƁB
GDP���������Ă����Ԃ��s�����^�ŁAGTP���������Ă����Ԃ������^�B
G�^���p�N���͕��i��GDP�ƌ��������s�����^��G�^���p�N���Ƃ��đ��݂��A
�h�����A
G�^���p�N������GDP�𗣂�GTP�����̃O�A�j���k�N���I�`�h�����������N����A
�����^��G�^���p�N���֕ϊ��A�V�O�i���`�B���s����B
G�^���p�N���͎O�ʑ�G�^���p�N���ƒᕪ�q��G�^���p�N���̂Q��ށB
G�^���p�N�������^��e�́iGPCR�FG Protein-Coupled Receptor�j�A
���̎O�ʑ�G�^���p�N������ăV�O�i���`�B���s���A
�y�����_��������V�O�i���`�B�z
�����̃^���p�N���́A���܂��܂ȉ��w�C�����邱�Ƃɂ����
�R���t�H���[�V������y�f�����Ȃǂ�ω�������B
�^���p�N���̉��w�C���́AmRNA���^���p�N���ւƖ|�ꂽ��ɍs����^���p�N���̋@�\����̋@�\�ŁA���Ƀ^���p�N���̖|���C���ƌĂԁB
�^���p�N���̖|���C���̑�\�I�Ȃ��̂́A�����_��
���̑� �A�Z�`�����A���`�����A���r�L�`�����A�����t���A�����t���Ȃǂ�����B
�^���p�N���́A�L�i�[�[�i�����_���y�f�j�ɂ���ă����_������A
�z�X�t�@�^�[�[�i�E�����_���y�f�j�ɂ���ĒE�����_�������B
�����̃^���p�N���́A�����_����E�����_������Ċ��������߂����B
���̂��߁A�h���ɂ���ăL�i�[�[�ɂ�郊���_���@
�z�X�t�@�^�[�[�ɂ��E�����_�����邱�ƂŁA
�^���p�N��������������V�O�i���`�B���s����B
�܂������_���ɂ�芈���������^���p�N�����������A
���ɂ̓����_���ɂ��s���������^���p�N��������B
�^���p�N���̖|���C���̎�ȓ���
�E�����_���E�E�E�^���p�N���̊����̐���Ȃ�
�E�A�Z�`������`�����E�E�E�^���p�N���̊����̐���Ȃ�
�E�|�����r�L�`�����E�E�E�v���e�A�\�[���ɂ�镪���̎w�W
�E�����t���E�E�E�זE���Ǎ݂Ȃǂ𐧌�i�זE���ւ̖��ߍ��݁A���E�̖��ւ̖��ߍ��݂Ȃǁj
�E�����t���E�E�E���^���p�N���ɑ���������
�y�Z�J���h���b�Z���W���[�z
�Ƃ͍זE���Ŏ�e�̂�������V�O�i�����זE���Œ��p���镪�q�̂��ƁB
���Ȃ݂ɁA��e�̂Ɍ�������V�O�i�����q���t�@�[�X�g���b�Z���W���[�B
�Z�J���h���b�Z���W���[�A
�EcAMP
�E�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�F�C�m�V�g�[��1,4,5-�O�����_�j
�ECa2�{
�Ȃǂ�����B
�ȉ��A������
�Z�J���h���b�Z���W���[���Y������G�t�F�N�^�[���q��
�Z�J���h���b�Z���W���[�ɂ�芈��������镪�q���܂Ƃ߁B
�E�A�f�j���_�V�N���[�[��cAMP���v���e�C���L�i�[�[A�iPKA�j
�E�z�X�z���p�[�[C�iPLC�j���W�A�V���O���Z���[���iDG)�ƃC�m�V�g�[���R�����_�iIP3�j��
�v���e�C���L�i�[�[C�iPKC�j��J�����W�������ˑ����v���e�C���L�i�[�[�iCaM�L�i�[�[�j
�E�C�I���`���l����Ca2�{���J�����W�������ˑ����v���e�C���L�i�[�[�iCaM�L�i�[�[�j
�Ɓ@���̂��������̓��X
�V�O�i���`�B�̎d�g�݂𗝉����邽�߂ɁA
�ǂ̂悤�ɂ��ăV�O�i�����q�����������ꂽ��s�����������̂���T��B
�V�O�i���`�B�̗l���A
�EG�^���p�N��guanine nucleotide-binding proteins, ������V�O�i���`�B
�E�����_��phosphorylation������V�O�i���`�B
�E�Z�J���h���b�Z���W���[Second messenger system������V�O�i���`�B
�yG�^���p�N���z
�Ƃ́AGTP�����^���p�N���̂��ƁB
GDP���������Ă����Ԃ��s�����^�ŁAGTP���������Ă����Ԃ������^�B
G�^���p�N���͕��i��GDP�ƌ��������s�����^��G�^���p�N���Ƃ��đ��݂��A
�h�����A
G�^���p�N������GDP�𗣂�GTP�����̃O�A�j���k�N���I�`�h�����������N����A
�����^��G�^���p�N���֕ϊ��A�V�O�i���`�B���s����B
G�^���p�N���͎O�ʑ�G�^���p�N���ƒᕪ�q��G�^���p�N���̂Q��ށB
G�^���p�N�������^��e�́iGPCR�FG Protein-Coupled Receptor�j�A
���̎O�ʑ�G�^���p�N������ăV�O�i���`�B���s���A
�y�����_��������V�O�i���`�B�z
�����̃^���p�N���́A���܂��܂ȉ��w�C�����邱�Ƃɂ����
�R���t�H���[�V������y�f�����Ȃǂ�ω�������B
�^���p�N���̉��w�C���́AmRNA���^���p�N���ւƖ|�ꂽ��ɍs����^���p�N���̋@�\����̋@�\�ŁA���Ƀ^���p�N���̖|���C���ƌĂԁB
�^���p�N���̖|���C���̑�\�I�Ȃ��̂́A�����_��
���̑� �A�Z�`�����A���`�����A���r�L�`�����A�����t���A�����t���Ȃǂ�����B
�^���p�N���́A�L�i�[�[�i�����_���y�f�j�ɂ���ă����_������A
�z�X�t�@�^�[�[�i�E�����_���y�f�j�ɂ���ĒE�����_�������B
�����̃^���p�N���́A�����_����E�����_������Ċ��������߂����B
���̂��߁A�h���ɂ���ăL�i�[�[�ɂ�郊���_���@
�z�X�t�@�^�[�[�ɂ��E�����_�����邱�ƂŁA
�^���p�N��������������V�O�i���`�B���s����B
�܂������_���ɂ�芈���������^���p�N�����������A
���ɂ̓����_���ɂ��s���������^���p�N��������B
�^���p�N���̖|���C���̎�ȓ���
�E�����_���E�E�E�^���p�N���̊����̐���Ȃ�
�E�A�Z�`������`�����E�E�E�^���p�N���̊����̐���Ȃ�
�E�|�����r�L�`�����E�E�E�v���e�A�\�[���ɂ�镪���̎w�W
�E�����t���E�E�E�זE���Ǎ݂Ȃǂ𐧌�i�זE���ւ̖��ߍ��݁A���E�̖��ւ̖��ߍ��݂Ȃǁj
�E�����t���E�E�E���^���p�N���ɑ���������
�y�Z�J���h���b�Z���W���[�z
�Ƃ͍זE���Ŏ�e�̂�������V�O�i�����זE���Œ��p���镪�q�̂��ƁB
���Ȃ݂ɁA��e�̂Ɍ�������V�O�i�����q���t�@�[�X�g���b�Z���W���[�B
�Z�J���h���b�Z���W���[�A
�EcAMP
�E�W�A�V���O���Z���[���iDG�j�ƃC�m�V�g�[���R�����_�iIP3�F�C�m�V�g�[��1,4,5-�O�����_�j
�ECa2�{
�Ȃǂ�����B
�ȉ��A������
�Z�J���h���b�Z���W���[���Y������G�t�F�N�^�[���q��
�Z�J���h���b�Z���W���[�ɂ�芈��������镪�q���܂Ƃ߁B
�E�A�f�j���_�V�N���[�[��cAMP���v���e�C���L�i�[�[A�iPKA�j
�E�z�X�z���p�[�[C�iPLC�j���W�A�V���O���Z���[���iDG)�ƃC�m�V�g�[���R�����_�iIP3�j��
�v���e�C���L�i�[�[C�iPKC�j��J�����W�������ˑ����v���e�C���L�i�[�[�iCaM�L�i�[�[�j
�E�C�I���`���l����Ca2�{���J�����W�������ˑ����v���e�C���L�i�[�[�iCaM�L�i�[�[�j
�Ɓ@���̂��������̓��X
posted by ���������� at 23:16| �G���^�[�e�C�����g
2023�N02��02��
Alchemy of Actor Signal transduction�V�O�i���`�B�@01
Alchemy of Actor Signal transduction01
�זE���ǂ̂悤�ɂ��čזE�O�̃V�O�i�����q��F������̂�?
�זE�O�̃V�O�i�����q�́A���K���h�i��e�̂ɓ��ٓI�Ɍ������镨���j�Ƃ��āA�זE�����邢�͍זE���ɑ��݂����e�̂Ɍ������A�זE���V�O�i���`�B�������N�����B
��e�̂��Q�̃^�C�v�ɕ��ށB
�@�זE����e�́E�E�EG�^���p�N�������^��e�́A�y�f�����^��e�́A�C�I���`���l�������^��e��
�A�זE����e�́E�E�E�j����e��
�y�זE����e�́z
�wG�^���p�N�������^��e��GPCR�x
���n���̃V�O�i�����q�́A������d�w����Ȃ�זE����ʉ߂��邱�Ƃ͂ł��Ȃ��̂ŁA
�זE���ɑ��݂����e�̂���V�O�i���`�B���B
G�^���p�N���F�O�A�j���k�N���I�`�h�����^���p�N���B
�́uGDP���邢��GTP����������^���p�N���̑��́v�B
����G�^���p�N����GDP���������Ă����Ԃ��s�����^�ŁAGTP���������Ă����Ԃ������^�ɂȂ�B
���̂��߁AG�^���p�N���́A����GDP��GTP�̌�����Ԃ�ω������邱�Ƃɂ���āA
���܂��܂Ȏh���ɉ����Ċ����^�ƕs�����^���s��������B
����G�^���p�N���u�O�ʑ�G�^���p�N���v�Ɓu�ᕪ�q��G�^���p�N���v�̂Q��ނ���B
G�^���p�N�������^��e�̂́A���̎O�ʑ�G�^���p�N�����������Ă���7�ђʌ^�̎�e�́B
����7�ђʌ^�̍\���́AG�^���p�N�������^��e�̂̑傫�ȓ����̈�B
G�^���p�N�������^��e�̂Ƀ��K���h����������ɂ���āAG�^���p�N���̃��T�u���j�b�g����GDP���𗣂��AGTP���������邱�ƂŁA�זE���V�O�i���`�B���i�s�B
���̂V�ђʌ^��G�^���p�N�������^��e�̂ɂ́A�A�h���i������e�̂�O���J�S����e�̂Ȃǂ�����B
�����ݎs�̂���Ă����̑����́A�V�ђʌ^��G�^���p�N�������^��e�̂��^�[�Q�b�g�B
�זE���ɑ��݂��A��e�̂Ƃ͋������Ă��Ȃ��ᕪ�q��G�^���p�N���ɂ�
GDP��GTP�Ɍ���������q�u�O�A�j���k�N���I�`�h�������q
�iGuanine nucleotide Exchange Factor�FGEF�j�v�����������������B
G�^���p�N�����̂́A�アGTPase�����iGTP��GDP�ɉ�����������y�f�����j�������A
G�^���p�N�����g�ł́A������G�^���p�N����s�����^�ɂ����ɖ߂����Ƃ͂ł���B
�����ŁA
�זE���ɂ�G�^���p�N��������GTPase����������������
�uGTPase�������^���p�N���iGTPase- activating protein�FGAP�j�v���q�����݂��@
�����^��G�^���p�N����s�����^�֖߂��B
�w�y�f�����^��e�́x
�Ƃ́A���g���y�f����������e�̂��邢�́A�y�f�����ڌ������Ă����e�̂̂��ƁB
�זE�O�̃V�O�i�����q�����K���h�Ƃ��āA��e�̂Ɍ�������ƍזE���̍y�f�����������A
�זE���V�O�i���`�B���i�s�B
Exa,�`���V���L�i�[�[���������C���X������e�́B
�w�C�I���`���l�������^��e�́x
�Ƃ́A���K���h���������邱�ƂŃ`���l�����J�����A�זE���O�̃C�I����ʉ߂�����^�C�v�̎�e��
�y�זE���ɑ��݂����e�́i�j����e�́j�z
�a�����̃V�O�i�����q�́A
������d�w����Ȃ�זE����ʉ߂��邱�Ƃ��ł���̂ŁA�זE���Ɏ�荞�܂�A
�זE���ɑ��݂����e�́i�j����e�́j����V�O�i���`�B�B
���j����e�̂Ƃ́A���i�͍זE���ɑ��݂��邪�A
���K���h�����ɂ��j���ւƈڍs�A�]�ʈ��q�Ƃ��ĕW�I��`�q�̔����߂���^�C�v�̎�e�́B
�����a�����̕����@exa,�r�^�~��A��r�^�~��D�Ȃǂ̎��n���r�^�~���A�X�e���C�h�z�������Ȃǂ�����B
�Ɓ@���̂��������̓��X
�זE���ǂ̂悤�ɂ��čזE�O�̃V�O�i�����q��F������̂�?
�זE�O�̃V�O�i�����q�́A���K���h�i��e�̂ɓ��ٓI�Ɍ������镨���j�Ƃ��āA�זE�����邢�͍זE���ɑ��݂����e�̂Ɍ������A�זE���V�O�i���`�B�������N�����B
��e�̂��Q�̃^�C�v�ɕ��ށB
�@�זE����e�́E�E�EG�^���p�N�������^��e�́A�y�f�����^��e�́A�C�I���`���l�������^��e��
�A�זE����e�́E�E�E�j����e��
�y�זE����e�́z
�wG�^���p�N�������^��e��GPCR�x
���n���̃V�O�i�����q�́A������d�w����Ȃ�זE����ʉ߂��邱�Ƃ͂ł��Ȃ��̂ŁA
�זE���ɑ��݂����e�̂���V�O�i���`�B���B
G�^���p�N���F�O�A�j���k�N���I�`�h�����^���p�N���B
�́uGDP���邢��GTP����������^���p�N���̑��́v�B
����G�^���p�N����GDP���������Ă����Ԃ��s�����^�ŁAGTP���������Ă����Ԃ������^�ɂȂ�B
���̂��߁AG�^���p�N���́A����GDP��GTP�̌�����Ԃ�ω������邱�Ƃɂ���āA
���܂��܂Ȏh���ɉ����Ċ����^�ƕs�����^���s��������B
����G�^���p�N���u�O�ʑ�G�^���p�N���v�Ɓu�ᕪ�q��G�^���p�N���v�̂Q��ނ���B
G�^���p�N�������^��e�̂́A���̎O�ʑ�G�^���p�N�����������Ă���7�ђʌ^�̎�e�́B
����7�ђʌ^�̍\���́AG�^���p�N�������^��e�̂̑傫�ȓ����̈�B
G�^���p�N�������^��e�̂Ƀ��K���h����������ɂ���āAG�^���p�N���̃��T�u���j�b�g����GDP���𗣂��AGTP���������邱�ƂŁA�זE���V�O�i���`�B���i�s�B
���̂V�ђʌ^��G�^���p�N�������^��e�̂ɂ́A�A�h���i������e�̂�O���J�S����e�̂Ȃǂ�����B
�����ݎs�̂���Ă����̑����́A�V�ђʌ^��G�^���p�N�������^��e�̂��^�[�Q�b�g�B
�זE���ɑ��݂��A��e�̂Ƃ͋������Ă��Ȃ��ᕪ�q��G�^���p�N���ɂ�
GDP��GTP�Ɍ���������q�u�O�A�j���k�N���I�`�h�������q
�iGuanine nucleotide Exchange Factor�FGEF�j�v�����������������B
G�^���p�N�����̂́A�アGTPase�����iGTP��GDP�ɉ�����������y�f�����j�������A
G�^���p�N�����g�ł́A������G�^���p�N����s�����^�ɂ����ɖ߂����Ƃ͂ł���B
�����ŁA
�זE���ɂ�G�^���p�N��������GTPase����������������
�uGTPase�������^���p�N���iGTPase- activating protein�FGAP�j�v���q�����݂��@
�����^��G�^���p�N����s�����^�֖߂��B
�w�y�f�����^��e�́x
�Ƃ́A���g���y�f����������e�̂��邢�́A�y�f�����ڌ������Ă����e�̂̂��ƁB
�זE�O�̃V�O�i�����q�����K���h�Ƃ��āA��e�̂Ɍ�������ƍזE���̍y�f�����������A
�זE���V�O�i���`�B���i�s�B
Exa,�`���V���L�i�[�[���������C���X������e�́B
�w�C�I���`���l�������^��e�́x
�Ƃ́A���K���h���������邱�ƂŃ`���l�����J�����A�זE���O�̃C�I����ʉ߂�����^�C�v�̎�e��
�y�זE���ɑ��݂����e�́i�j����e�́j�z
�a�����̃V�O�i�����q�́A
������d�w����Ȃ�זE����ʉ߂��邱�Ƃ��ł���̂ŁA�זE���Ɏ�荞�܂�A
�זE���ɑ��݂����e�́i�j����e�́j����V�O�i���`�B�B
���j����e�̂Ƃ́A���i�͍זE���ɑ��݂��邪�A
���K���h�����ɂ��j���ւƈڍs�A�]�ʈ��q�Ƃ��ĕW�I��`�q�̔����߂���^�C�v�̎�e�́B
�����a�����̕����@exa,�r�^�~��A��r�^�~��D�Ȃǂ̎��n���r�^�~���A�X�e���C�h�z�������Ȃǂ�����B
�Ɓ@���̂��������̓��X
posted by ���������� at 00:06| �G���^�[�e�C�����g
2023�N01��31��
Alchemy of Actor Signal transduction�V�O�i���`�B�@00
Alchemy of Actor Signal transduction�V�O�i���`�B�@00
�H���ێ�Ō����l���㏸����A
�C���X����(�X���זE���番��)�́A�W�I�זE(���i�⎉�b�g�D�Ȃ�)�ɍ�p������荞�݂����i�A
�����l��ቺ������B
�����̉ߒ��ł́A
�܂��u�����l�㏸�v�Ƃ����h������e���A
�u�C���X�����v�z�������̌`�ŏ���`�B�i����`�B���镨��:�V�O�i�����q�j�B
���̏�W�I�זE�ɓ`�B����@
����ɍזE���ŃV�O�i���`�B���A�������i�V�O�i�����}���ɑ������Ă����l��:�J�X�P�[�h�j�A
�ŏI�I�Ɂu�����l�ቺ�v�Ƃ����������N����B
���̂Ƃ��A�זE���זE�O�̃V�O�i�����q�����m���A�זE���ɂ��̏���`���Ă����ߒ��F�V�O�i���`�B
�זE�͂��܂��܂ȃV�O�i�����q�̏����Ɏ��A�זE���ł��܂��܂ȃV�O�i���`�B�������������B�ʁX�̃V�O�i���`�B���݂��ɓƗ������o�H�����ǂ邾���łȂ��A
���ꂼ�ꂪ�݂��ɉe���������č�p����F�V�O�i���`�B�̃N���X�g�[�N
�V�O�i���`�B�@�̂R�̒i�K�B
�@�u�זE�ԃV�O�i���`�B�v
�@�u�זE�ɂ�����V�O�i�����q�̎�e�i��e�̂ɂ��F���j�v
�@�u�זE���V�O�i���`�B�v
�y�זE�ԃV�O�i���`�B�z�̂T��ނ̗l���B
�@�G���h�N�����^�i������^�j�F
�זE���番�傳�ꂽ�z�����������t��ʂ��ĕW�I�זE�܂ʼn^���^�C�v�̃V�O�i���`�B�̗l��
�A�p���N�����^�i�T����^�j�F
�זE���番�傳�ꂽ�������Ǐ��I�ɋߗׂ����זE�ɍ�p����^�C�v�̃V�O�i���`�B�̗l��
�B�I�[�g�N�����^�i���ȕ���^�j�F
�זE���番�傳�ꂽ�������������g�ɍ�p����^�C�v�̃V�O�i���`�B�̗l���B
����l���Ƃ��ẮA�p���N�����^�i�T����^�j�Ɠ���
�C�זE�ڐG�^�F
�ڐG���������זE���m�����̍זE�̕\�ʂɒ���������ʂ��ď���`�B����^�C�v�̃V�O�i���`�B�̗l���i����^�ł͂Ȃ��j
�D�_�o�^�i�V�i�v�X�^�j�F
�_�o�זE�̃V�i�v�X����_�o�`�B���������o����邱�Ƃɂ���āA����v���ɓ`�B����^�C�v�̃V�O�i���`�B�̗l��
�Ɓ@���̂��������̓��X
�H���ێ�Ō����l���㏸����A
�C���X����(�X���זE���番��)�́A�W�I�זE(���i�⎉�b�g�D�Ȃ�)�ɍ�p������荞�݂����i�A
�����l��ቺ������B
�����̉ߒ��ł́A
�܂��u�����l�㏸�v�Ƃ����h������e���A
�u�C���X�����v�z�������̌`�ŏ���`�B�i����`�B���镨��:�V�O�i�����q�j�B
���̏�W�I�זE�ɓ`�B����@
����ɍזE���ŃV�O�i���`�B���A�������i�V�O�i�����}���ɑ������Ă����l��:�J�X�P�[�h�j�A
�ŏI�I�Ɂu�����l�ቺ�v�Ƃ����������N����B
���̂Ƃ��A�זE���זE�O�̃V�O�i�����q�����m���A�זE���ɂ��̏���`���Ă����ߒ��F�V�O�i���`�B
�זE�͂��܂��܂ȃV�O�i�����q�̏����Ɏ��A�זE���ł��܂��܂ȃV�O�i���`�B�������������B�ʁX�̃V�O�i���`�B���݂��ɓƗ������o�H�����ǂ邾���łȂ��A
���ꂼ�ꂪ�݂��ɉe���������č�p����F�V�O�i���`�B�̃N���X�g�[�N
�V�O�i���`�B�@�̂R�̒i�K�B
�@�u�זE�ԃV�O�i���`�B�v
�@�u�זE�ɂ�����V�O�i�����q�̎�e�i��e�̂ɂ��F���j�v
�@�u�זE���V�O�i���`�B�v
�y�זE�ԃV�O�i���`�B�z�̂T��ނ̗l���B
�@�G���h�N�����^�i������^�j�F
�זE���番�傳�ꂽ�z�����������t��ʂ��ĕW�I�זE�܂ʼn^���^�C�v�̃V�O�i���`�B�̗l��
�A�p���N�����^�i�T����^�j�F
�זE���番�傳�ꂽ�������Ǐ��I�ɋߗׂ����זE�ɍ�p����^�C�v�̃V�O�i���`�B�̗l��
�B�I�[�g�N�����^�i���ȕ���^�j�F
�זE���番�傳�ꂽ�������������g�ɍ�p����^�C�v�̃V�O�i���`�B�̗l���B
����l���Ƃ��ẮA�p���N�����^�i�T����^�j�Ɠ���
�C�זE�ڐG�^�F
�ڐG���������זE���m�����̍זE�̕\�ʂɒ���������ʂ��ď���`�B����^�C�v�̃V�O�i���`�B�̗l���i����^�ł͂Ȃ��j
�D�_�o�^�i�V�i�v�X�^�j�F
�_�o�זE�̃V�i�v�X����_�o�`�B���������o����邱�Ƃɂ���āA����v���ɓ`�B����^�C�v�̃V�O�i���`�B�̗l��
�Ɓ@���̂��������̓��X
posted by ���������� at 12:10| �G���^�[�e�C�����g