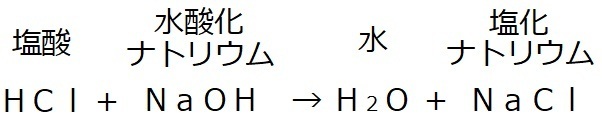�V�K�L���̓��e���s�����ƂŁA��\���ɂ��邱�Ƃ��\�ł��B
�L��
�V�K�L���̓��e���s�����ƂŁA��\���ɂ��邱�Ƃ��\�ł��B
posted by fanblog
2020�N10��29��
�����F�M��d�C�ŕ������Ă��܂����IPart.�R
����ɂ��́AYOSHIO�ł��B
����͉��w�ω��̂U��ځA�����̃|�C���gPart.�R�ł��B
��������w�ω��E�����̓��X�g�ł��B
�c�����A���X�g���������Ă��Ȃ�̋��G�Ȃ̂ŁA
�����ЂƓ���A�撣��܂��傤�ˁB
�����Part.�R�Ƃ��āA
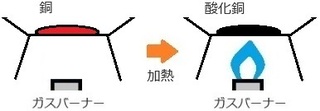
(�R) �Y�_���f�i�g���E���̉��M����
�ł��B
��j�Y�_���f�i�g���E�������M����ƁA
�Y�_���f�i�g���E���A��_���Y�f�A���ɕ��������B
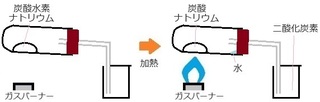
(�P) ���������w����
�E����������� �c �Y�_���f�i�g���E���FNaHCO�R
�E����������� �c �Y�_�i�g���E���FNa�QCO�R
�@�@�@�@�@�@�@�@ ���FH�QO�@
�@�@�@�@�@�@�@�@ ��_���Y�f�FCO�Q
�ʓ|�Ȃ��Ƃ��Ԃ₭�ƁA
�Y�_���f�i�g���E�� �� �Y�_�i�g���E����
�{���ɕ���킵���ł��B
�c�N������ȊԈႢ�₷�����w�����l�����̂ł��傤���c�B
�o���ԈႢ�E�Q�Ăď����ԈႢ�����Ȃ��悤�ɁA
���ӂ��Ċo���܂��傤�B
(�Q) ���w������
�QNaHCO�R �� Na�QCO�R �{ H�QO �{ CO�Q
�Y�_���f�i�g���E�� NaHCO�R �̑O��
�Q��t���Đ����킹���܂��B
(�R) �����̃|�C���g
���w�����̍œ�ւ��������āA
�����̃|�C���g�͍��܂ł̒��ň�Ԑ[���A
���ӂ����������̃|�C���g�͂Q�ł��B
�P�ڂ́A����������̂ɒ��ڂ���ƁA
�ő́E�t�́E�C�̂̕��������ꂼ�ꂠ�邱���ł��B
�ő� �c �Y�_���f�i�g���E��
�t�� �c ��
�C�� �c ��_���Y�f
�ő̈ȊO�͗��Ȃœ���݂����镨���ł����A
���ʓ_�������ɂ����A���ȑg�ݍ��킹�ł��c�B
�Q�ڂ́A��}���������������ǂ̌���
���������Ă��邱���ł��B
����́A���M�����Ŕ�����������
���M�����ɐ�������Ď����ǂ�����Ă��܂��̂�h�������ł��B
�L�q���ŏo�肳��邱�Ƃ�����̂ŁA
�`�F�b�N���Ă������Ƃ��������߂��܂��B
(�S) ���̃|�C���g
(�R)�����̃|�C���g�Ɠ��l�Ɉ�Ԑ[���ł����A
�e�X�g�ł����ӂ������|�C���g���Q����܂��B
�P�ڂ́A�����Ǔ��ɔ����������̒��ו��ł��B
���ׂ���@�́A�����R�o���g�������g�p���܂��B
�����R�o���g���́A����t���邱�ƂŁA
�F�����ԐF�܂������F�ɕω����܂��B
���F�ɂ��ẮA���ȏ���搶�̎w����
�]���̂��ǂ��ł��傤�B
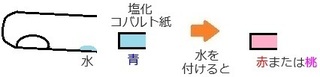
�Q�ڂ́A�����O�̒Y�_���f�i�g���E���ƁA
������̒Y�_�i�g���E���ɂ����ł��B
���́A���̂Q�̕����ɑ傫�ȈႢ�͂Ȃ��A
�E���n�t���A���J�����ł���
�E�����ő��ł���
�Ƃ������ʓ_������܂��B
�����A
�t�F�m�[���t�^���C���n�t���g�p����ƁA
�E�Y�_���f�i�g���E���́A�����s���N
�E�Y�_�i�g���E���́A�Z���s���N
���Z���̈Ⴂ���o�邱�Ƃ͋�ʂ��Ă����K�v������܂��B
�ł́A�Y�_���f�i�g���E���̉��M�����̃|�C���g�͂R�B
�@ ����킵�����w���ɗv����
�A ���̒��ו��������R�o���g���ŐԐF�ω�
�B �Y�_���f�i�g���E���ƒY�_�i�g���E�������ʓ_������
�c���炭�A����͓��e�����肾���������̂ŁA
�ǂ݂Â炢�������������Ǝv���܂��B�B�B
�U��ɓn���āA�����E�_���E�Ҍ��E����
�������Ă��܂����B
�o���邱�Ƃ��`�F�b�N���₷���c�[�����A
����ȍ~�̃u���O�ŃA�b�v�ł���ƍl���Ă��܂��B
��e�ʂ�Part.�R�ɂ��t��������������A
�{���ɂ��肪�Ƃ��������܂��I
�O��܂ł̉��w�����������፬���ɂȂ�Ȃ��悤�ɁA
�Y�_���f�i�g���E���̉��M�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
����͉��w�ω��̂U��ځA�����̃|�C���gPart.�R�ł��B
��������w�ω��E�����̓��X�g�ł��B
�c�����A���X�g���������Ă��Ȃ�̋��G�Ȃ̂ŁA
�����ЂƓ���A�撣��܂��傤�ˁB
�����Part.�R�Ƃ��āA
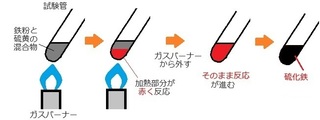
(�R) �Y�_���f�i�g���E���̉��M����
�ł��B
��j�Y�_���f�i�g���E�������M����ƁA
�Y�_���f�i�g���E���A��_���Y�f�A���ɕ��������B

(�P) ���������w����
�E����������� �c �Y�_���f�i�g���E���FNaHCO�R
�E����������� �c �Y�_�i�g���E���FNa�QCO�R
�@�@�@�@�@�@�@�@ ���FH�QO�@
�@�@�@�@�@�@�@�@ ��_���Y�f�FCO�Q
�ʓ|�Ȃ��Ƃ��Ԃ₭�ƁA
�Y�_���f�i�g���E�� �� �Y�_�i�g���E����
�{���ɕ���킵���ł��B
�c�N������ȊԈႢ�₷�����w�����l�����̂ł��傤���c�B
�o���ԈႢ�E�Q�Ăď����ԈႢ�����Ȃ��悤�ɁA
���ӂ��Ċo���܂��傤�B
(�Q) ���w������
�QNaHCO�R �� Na�QCO�R �{ H�QO �{ CO�Q
�Y�_���f�i�g���E�� NaHCO�R �̑O��
�Q��t���Đ����킹���܂��B
(�R) �����̃|�C���g
���w�����̍œ�ւ��������āA
�����̃|�C���g�͍��܂ł̒��ň�Ԑ[���A
���ӂ����������̃|�C���g�͂Q�ł��B
�P�ڂ́A����������̂ɒ��ڂ���ƁA
�ő́E�t�́E�C�̂̕��������ꂼ�ꂠ�邱���ł��B
�ő� �c �Y�_���f�i�g���E��
�t�� �c ��
�C�� �c ��_���Y�f
�ő̈ȊO�͗��Ȃœ���݂����镨���ł����A
���ʓ_�������ɂ����A���ȑg�ݍ��킹�ł��c�B
�Q�ڂ́A��}���������������ǂ̌���
���������Ă��邱���ł��B
����́A���M�����Ŕ�����������
���M�����ɐ�������Ď����ǂ�����Ă��܂��̂�h�������ł��B
�L�q���ŏo�肳��邱�Ƃ�����̂ŁA
�`�F�b�N���Ă������Ƃ��������߂��܂��B
(�S) ���̃|�C���g
(�R)�����̃|�C���g�Ɠ��l�Ɉ�Ԑ[���ł����A
�e�X�g�ł����ӂ������|�C���g���Q����܂��B
�P�ڂ́A�����Ǔ��ɔ����������̒��ו��ł��B

���ׂ���@�́A�����R�o���g�������g�p���܂��B
�����R�o���g���́A����t���邱�ƂŁA
�F�����ԐF�܂������F�ɕω����܂��B
���F�ɂ��ẮA���ȏ���搶�̎w����
�]���̂��ǂ��ł��傤�B
�Q�ڂ́A�����O�̒Y�_���f�i�g���E���ƁA
������̒Y�_�i�g���E���ɂ����ł��B
���́A���̂Q�̕����ɑ傫�ȈႢ�͂Ȃ��A
�E���n�t���A���J�����ł���
�E�����ő��ł���
�Ƃ������ʓ_������܂��B
�����A
�t�F�m�[���t�^���C���n�t���g�p����ƁA
�E�Y�_���f�i�g���E���́A�����s���N
�E�Y�_�i�g���E���́A�Z���s���N
���Z���̈Ⴂ���o�邱�Ƃ͋�ʂ��Ă����K�v������܂��B
�ł́A�Y�_���f�i�g���E���̉��M�����̃|�C���g�͂R�B
�@ ����킵�����w���ɗv����
�A ���̒��ו��������R�o���g���ŐԐF�ω�
�B �Y�_���f�i�g���E���ƒY�_�i�g���E�������ʓ_������
�c���炭�A����͓��e�����肾���������̂ŁA
�ǂ݂Â炢�������������Ǝv���܂��B�B�B
�U��ɓn���āA�����E�_���E�Ҍ��E����
�������Ă��܂����B
�o���邱�Ƃ��`�F�b�N���₷���c�[�����A
����ȍ~�̃u���O�ŃA�b�v�ł���ƍl���Ă��܂��B
��e�ʂ�Part.�R�ɂ��t��������������A
�{���ɂ��肪�Ƃ��������܂��I
�O��܂ł̉��w�����������፬���ɂȂ�Ȃ��悤�ɁA
�Y�_���f�i�g���E���̉��M�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
�y���̃J�e�S���[�̍ŐV�L���z
-
no image
2020�N10��28��
�����F�M��d�C�ŕ������Ă��܂����IPart.�Q
����ɂ��́AYOSHIO�ł��B
����͉��w�ω��̂T��ځA�����̃|�C���gPart.�Q�ł��B
�O��Part.�P�́A�_����̉��M�����ł����B
�����Part.�Q�Ƃ��āA
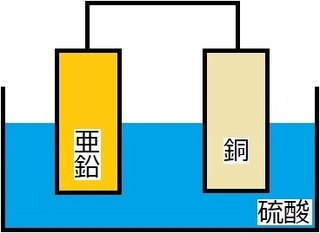
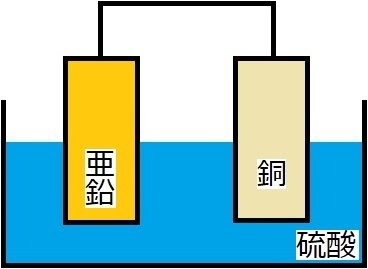
(�Q) ���̓d�C����
�ł��B
��j����d�C�������邱�ƂŁA���f�Ǝ_�f��������B
(�P) ���������w����
�E������������ �c ���FH�QO
�E������������ �c ���f�FH�Q�@�@�_�f�FO�Q
(�Q) ���w������
�QH�QO�@���@�QH�Q �{ O�Q
�� H�QO �Ɛ��f H�Q �̑O�ɂQ��t���Đ����킹���܂��B
���w������l�������ɁA
H�QO ���AH�Q �� O�Q �ɕ�������ƍl�������
�y��������܂���B
(�R) �����̃|�C���g
����̂悤�ɁA�����ɓd�C�𗬂����Ƃŕ���������@���A
�d�C�����ƌ����܂��B
(�S) ���̃|�C���g
���ӂ��ׂ��|�C���g�͂Q����܂��B
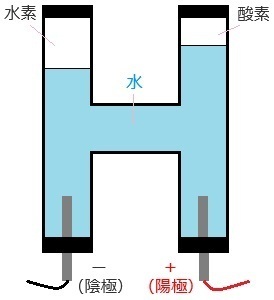
�P�ڂ́A���f�Ǝ_�f�̔�������̐ς̈Ⴂ�ł��B
��}�����������悤�ɁA
���f�̕����_�f������������̐ς������ł��B
�����ŁA�o���Ă��������|�C���g�́A
���f�̑̐ς́A�_�f�̑̐ς̂Q�{�������邱���ł��B
�Q�ڂ́A�B�ꂽ�|�C���g�ł����A�A�A
���ɓd�C���ʂ�₷���悤�A
���ʂ̐��_���i�g���E�����������Ă��邱���ł��B
�e�X�g�Ȃǂł́A
�E�d�����ʂ�₷���悤�������Ă��镨���͉����H
�E���ɏ��ʂ̐��_���i�g���E�����������Ă��闝�R���q�ׂ�B
�̂悤�Ȗ�肪�o�肳��邱�Ƃ�����܂��B
�����Ƃ��ẮA
�E�����镨���F���_���i�g���E��
�E�����闝�R�F�d���𗬂��₷����������
�ł��B
�� �������A���_���i�g���E���̑���ɁA
���_���g���ꍇ������܂��B
���ȏ����Ŋm�F���Ă݂Ă��������ˁB
�ł́A���̓d�C�����̃|�C���g���R�B
�@ �d�C�����Ƃ́A�d�C�𗬂��ĕ���������@
�A �����������f�̑̐��́A�_�f�̑̐ς��Q�{
�B ���ʂ����_���i�g���E���œd�C�𗬂��₷������
�ꌩ�A���̓d�C�����͒n���ł����A
�B�ꂽ�|�C���g���o������邱�Ƃ������ł��B
�������E�L�q���̃|�C���g�ɂ��Ȃ���̂ŁA
���w���E���w�������ƍ��킹��
�m�F���Ă����Ɨǂ��ł��傤�B
�B�ꂽ�|�C���g�����������ɁA
���̓d�C�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
����͉��w�ω��̂T��ځA�����̃|�C���gPart.�Q�ł��B
�O��Part.�P�́A�_����̉��M�����ł����B
�����Part.�Q�Ƃ��āA
(�Q) ���̓d�C����
�ł��B
��j����d�C�������邱�ƂŁA���f�Ǝ_�f��������B

(�P) ���������w����
�E������������ �c ���FH�QO
�E������������ �c ���f�FH�Q�@�@�_�f�FO�Q
(�Q) ���w������
�QH�QO�@���@�QH�Q �{ O�Q
�� H�QO �Ɛ��f H�Q �̑O�ɂQ��t���Đ����킹���܂��B
���w������l�������ɁA
H�QO ���AH�Q �� O�Q �ɕ�������ƍl�������
�y��������܂���B
(�R) �����̃|�C���g
����̂悤�ɁA�����ɓd�C�𗬂����Ƃŕ���������@���A
�d�C�����ƌ����܂��B
(�S) ���̃|�C���g
���ӂ��ׂ��|�C���g�͂Q����܂��B
�P�ڂ́A���f�Ǝ_�f�̔�������̐ς̈Ⴂ�ł��B
��}�����������悤�ɁA
���f�̕����_�f������������̐ς������ł��B
�����ŁA�o���Ă��������|�C���g�́A
���f�̑̐ς́A�_�f�̑̐ς̂Q�{�������邱���ł��B
�Q�ڂ́A�B�ꂽ�|�C���g�ł����A�A�A
���ɓd�C���ʂ�₷���悤�A
���ʂ̐��_���i�g���E�����������Ă��邱���ł��B
�e�X�g�Ȃǂł́A
�E�d�����ʂ�₷���悤�������Ă��镨���͉����H
�E���ɏ��ʂ̐��_���i�g���E�����������Ă��闝�R���q�ׂ�B
�̂悤�Ȗ�肪�o�肳��邱�Ƃ�����܂��B
�����Ƃ��ẮA
�E�����镨���F���_���i�g���E��
�E�����闝�R�F�d���𗬂��₷����������
�ł��B
�� �������A���_���i�g���E���̑���ɁA
���_���g���ꍇ������܂��B
���ȏ����Ŋm�F���Ă݂Ă��������ˁB
�ł́A���̓d�C�����̃|�C���g���R�B
�@ �d�C�����Ƃ́A�d�C�𗬂��ĕ���������@
�A �����������f�̑̐��́A�_�f�̑̐ς��Q�{
�B ���ʂ����_���i�g���E���œd�C�𗬂��₷������
�ꌩ�A���̓d�C�����͒n���ł����A
�B�ꂽ�|�C���g���o������邱�Ƃ������ł��B
�������E�L�q���̃|�C���g�ɂ��Ȃ���̂ŁA
���w���E���w�������ƍ��킹��
�m�F���Ă����Ɨǂ��ł��傤�B
�B�ꂽ�|�C���g�����������ɁA
���̓d�C�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
2020�N10��27��
�����F�M��d�C�ŕ������Ă��܂����IPart.�P
����ɂ��́AYOSHIO�ł��B
����͉��w�ω��̂S��ځA�����̃|�C���gPart.�P�ł��B
���Q���Ȃʼn������Ă������������́A
�S���łR��ނ���܂��B
������₷�����̂��爵���܂����A
�e�ʂ��傫���Ȃ�̂łR��ɕ����܂��B
(�P) �_����̉��M����
(�Q) ���̓d�C����
(�R) �Y�_���f�i�g���E���̉��M����
�ŁA
�����
(�P) �_����̉��M����
����܂Ƃ߂Ă����܂��B
�܂��͕��K����B
�����Ƃ́A�P�̕����𐫎����قȂ�Q�ȏ�̕����ɕω������锽���ł��B
�ł́A�_����̉��M�����ł��B
��j�_��������M����ƁA��Ǝ_�f�ɕ��������B
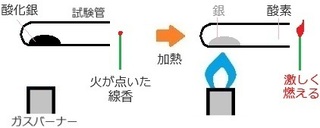
(�P) ���������w����
�E������������ �c �_����FAg�QO
�E������������ �c ��FAg�@�@�_�f�FO�Q
����l�����ɁA
�_����Ag�QO �� ��Ag �� �_�fO�Q ��
�������邭�炢�̊��o�ł����Ǝv���܂��B
(�Q) ���w������
�QAg�QO�@���@�SAg�{O�Q
�_����Ag�QO �̑O�ɂQ�A
��Ag �̑O�ɂS��t���Đ����킹���܂��B
(�R) �����̃|�C���g
�_��������M���邾���ŁA��Ǝ_�f�ɕ�����Ă��܂��܂��B
���̂悤�ɁA
���������M�����������A���M�����܂����M�����ƌ����܂��B
(�S) ���̃|�C���g
���ӂ��Ă��������|�C���g�́A
�������邱�ƂŔ�������_�f�̒��ו��ł��B
�m���Ɋo���Ă����������@�́A
���_�����������߂Â���ƁA�������R����
�Ȃ����̂�R�₷�������������Ă����܂��傤�B
�ł́A�_����̕����̃|�C���g���R�B
�@ �����Ƃ́A�P�̕������Q�̕����ɕ�����锽��
�A �_����̉��M�́A��Ǝ_�f�ɕ�����邾��
�B �_����̉��w��Ag�QO�A���w�������̍����ɗv����
�O����e�܂łƈႢ�A
�_�����ł���_����ɂQ���t������A
���w�������̐����킹�ɂS���t������A
�ʓ|�Ȋ����ł���ˁB�B�B
�ԈႢ�Ȃ���ł������̂ŁA
���w���𐳂����o���āA
���w�������̐����킹�ɂȂ�����悤��
�m�F���Ȃ���i�߂Ă݂܂��傤�B
�O����e�Ƌ�ʂ��Ȃ���A
�_����̉��M�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
����͉��w�ω��̂S��ځA�����̃|�C���gPart.�P�ł��B
���Q���Ȃʼn������Ă������������́A
�S���łR��ނ���܂��B
������₷�����̂��爵���܂����A
�e�ʂ��傫���Ȃ�̂łR��ɕ����܂��B
(�P) �_����̉��M����
(�Q) ���̓d�C����
(�R) �Y�_���f�i�g���E���̉��M����
�ŁA
�����
(�P) �_����̉��M����
����܂Ƃ߂Ă����܂��B
�܂��͕��K����B
�����Ƃ́A�P�̕����𐫎����قȂ�Q�ȏ�̕����ɕω������锽���ł��B
�ł́A�_����̉��M�����ł��B
��j�_��������M����ƁA��Ǝ_�f�ɕ��������B

(�P) ���������w����
�E������������ �c �_����FAg�QO
�E������������ �c ��FAg�@�@�_�f�FO�Q
����l�����ɁA
�_����Ag�QO �� ��Ag �� �_�fO�Q ��
�������邭�炢�̊��o�ł����Ǝv���܂��B
(�Q) ���w������
�QAg�QO�@���@�SAg�{O�Q
�_����Ag�QO �̑O�ɂQ�A
��Ag �̑O�ɂS��t���Đ����킹���܂��B
(�R) �����̃|�C���g
�_��������M���邾���ŁA��Ǝ_�f�ɕ�����Ă��܂��܂��B
���̂悤�ɁA
���������M�����������A���M�����܂����M�����ƌ����܂��B
(�S) ���̃|�C���g
���ӂ��Ă��������|�C���g�́A
�������邱�ƂŔ�������_�f�̒��ו��ł��B
�m���Ɋo���Ă����������@�́A
���_�����������߂Â���ƁA�������R����
�Ȃ����̂�R�₷�������������Ă����܂��傤�B
�ł́A�_����̕����̃|�C���g���R�B
�@ �����Ƃ́A�P�̕������Q�̕����ɕ�����锽��
�A �_����̉��M�́A��Ǝ_�f�ɕ�����邾��
�B �_����̉��w��Ag�QO�A���w�������̍����ɗv����
�O����e�܂łƈႢ�A
�_�����ł���_����ɂQ���t������A
���w�������̐����킹�ɂS���t������A
�ʓ|�Ȋ����ł���ˁB�B�B
�ԈႢ�Ȃ���ł������̂ŁA
���w���𐳂����o���āA
���w�������̐����킹�ɂȂ�����悤��
�m�F���Ȃ���i�߂Ă݂܂��傤�B
�O����e�Ƌ�ʂ��Ȃ���A
�_����̉��M�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
2020�N10��26��
�Ҍ��F�_�f�͕��C���m�I�I
����ɂ��́AYOSHIO�ł��B
����͉��w�ω��̂R��ځA�Ҍ��̃|�C���g�ł��B
�P��ڂ̉����E�Q��ڂ̎_���ƈႢ�A
����͕�����������锽���ɂ��Ă܂Ƃ߂Ă����܂��B
�܂��͕��K����B
�Ҍ��Ƃ́A�_��������_�f��藣�������ł��B
�d�v�|�C���g�́A�_�������K�v�ł��邱�Ƃł��B
�ł́A�����̂悤�ɗ�������Ă����܂��ˁB
��j�_�����ƒY�f�����̍����������M����ƁA
���Ɠ�_���Y�f���ł���B
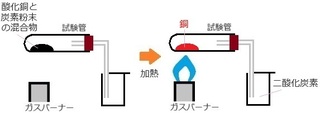
(�P) ���������w����
�E������������ �c �_�����FCuO�@�@�Y�f�FC�Q
�E������������ �c ���FCu�@�@��_���Y�f�FCO�Q
�_����CuO �� ��Cu �ցA
�Y�f C ���� ��_���Y�f CO�Q �ցA
�_�f�͓�����Y�f�S�ς�����N�����Ă��܂��B
�i�Ȃ̂ŁA�^�C�g�����u�_�f�͕��C���m�I�I�v�Ƃ��܂����c�B�j
(�Q) ���w������
�QCuO�{C2�@���@�QCu�{CO�Q
�_����CuO�Ɠ�Cu�̑O�ɂQ��t���Đ����킹���܂��B
(�R) �����̃|�C���g
�_�����͎_�f��藣���ē��ɂȂ�܂����A
��}�ɂ�����悤�ɁA
�����_��������A�Ԃ����֕ω����܂��B
�������E���w���E�F���Z�b�g�Ɋo���邱�Ƃ�
�������߂��܂��B
(�S) ���̃|�C���g
���ӂ��Ă��������|�C���g�́A��_���Y�f�̒��ו��ł��B
�m���Ɋo���Ă����������@�́A
�ΊD���ɓ���č���������������ł��B
���Ƃ́A��_���Y�f�͋�C���d�����C���Ȃ̂ŁA
�����u���܂�������u���ŏW�߂܂��B
��_���Y�f�̃|�C���g�Ƃ��Ċo���Ă����悤�ɂ��܂��傤�B
�ł́A�Ҍ��̃|�C���g�͂R�B
�@ �Ҍ��Ƃ́A�_���������_�f��藣������
�A �R���́A����M���Ď_�����鉻�w�ω�
�B �_���������A������
���������ƃ}�O�l�V�E�����قȂ邾���ŁA
���ʓ_�������_�����܂Ƃ߂Ă݂܂����B
�c���A�}�O�l�V�E���́A
�R�ĂƂ��������������E�_���������F
�Ƃ����e�X�g�ɏo�₷���|�C���g���������̂ŁA
�������ԈႢ���Ȃ��悤�Ɋo���Ă��������ˁB
�����̈Ⴂ�ɒ��ӂ��Ȃ���A
���w�ω��E�_���A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
����͉��w�ω��̂R��ځA�Ҍ��̃|�C���g�ł��B
�P��ڂ̉����E�Q��ڂ̎_���ƈႢ�A
����͕�����������锽���ɂ��Ă܂Ƃ߂Ă����܂��B
�܂��͕��K����B
�Ҍ��Ƃ́A�_��������_�f��藣�������ł��B
�d�v�|�C���g�́A�_�������K�v�ł��邱�Ƃł��B
�ł́A�����̂悤�ɗ�������Ă����܂��ˁB
��j�_�����ƒY�f�����̍����������M����ƁA
���Ɠ�_���Y�f���ł���B

(�P) ���������w����
�E������������ �c �_�����FCuO�@�@�Y�f�FC�Q
�E������������ �c ���FCu�@�@��_���Y�f�FCO�Q
�_����CuO �� ��Cu �ցA
�Y�f C ���� ��_���Y�f CO�Q �ցA
�_�f�͓�����Y�f�S�ς�����N�����Ă��܂��B
�i�Ȃ̂ŁA�^�C�g�����u�_�f�͕��C���m�I�I�v�Ƃ��܂����c�B�j
(�Q) ���w������
�QCuO�{C2�@���@�QCu�{CO�Q
�_����CuO�Ɠ�Cu�̑O�ɂQ��t���Đ����킹���܂��B
(�R) �����̃|�C���g
�_�����͎_�f��藣���ē��ɂȂ�܂����A
��}�ɂ�����悤�ɁA
�����_��������A�Ԃ����֕ω����܂��B
�������E���w���E�F���Z�b�g�Ɋo���邱�Ƃ�
�������߂��܂��B
(�S) ���̃|�C���g
���ӂ��Ă��������|�C���g�́A��_���Y�f�̒��ו��ł��B
�m���Ɋo���Ă����������@�́A
�ΊD���ɓ���č���������������ł��B
���Ƃ́A��_���Y�f�͋�C���d�����C���Ȃ̂ŁA
�����u���܂�������u���ŏW�߂܂��B
��_���Y�f�̃|�C���g�Ƃ��Ċo���Ă����悤�ɂ��܂��傤�B
�ł́A�Ҍ��̃|�C���g�͂R�B
�@ �Ҍ��Ƃ́A�_���������_�f��藣������
�A �R���́A����M���Ď_�����鉻�w�ω�
�B �_���������A������
���������ƃ}�O�l�V�E�����قȂ邾���ŁA
���ʓ_�������_�����܂Ƃ߂Ă݂܂����B
�c���A�}�O�l�V�E���́A
�R�ĂƂ��������������E�_���������F
�Ƃ����e�X�g�ɏo�₷���|�C���g���������̂ŁA
�������ԈႢ���Ȃ��悤�Ɋo���Ă��������ˁB
�����̈Ⴂ�ɒ��ӂ��Ȃ���A
���w�ω��E�_���A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
2020�N10��25��
�_���F���ƃ}�O�l�V�E���A���Ă���悤�ňႤ�H
����ɂ��́AYOSHIO�ł��B
����͉��w�ω��̂Q��ځA�_���̃|�C���g�ł��B
�P��ڂ̉����Ɠ����悤�ɁA
�|�C���g���i���Ă܂Ƃ߂Ă����܂��B
�܂��͕��K����B
�_���Ƃ́A�������_�f�ƌ��т������ŁA
�_���ɂ���Ăł����������_�����ƌ����܂��B
�ł́A������������Ă����܂��傤�B
��j�������M���ċ�C���̎_�f�Ɣ���������ƁA
�_�������ł���B
(�P) ���������w����
�E������������ �c ���FCu�@�@�_�f�FO�Q
�E������������ �c �_�����FCuO
�_���́A��{�I�ɋ����Ǝ_�f�̔����ł��邱�Ƃ��������Ă����܂��傤�B
(�Q) ���w������
�QCu�{O2�@���@�QCuO
��Cu�Ǝ_����CuO�̑O�ɂQ��t���Đ����킹���܂��B
(�R) �����̃|�C���g�@(�S) ���̃|�C���g�́A���R�����Č�قǁB
����́A�_���̗�������P�B
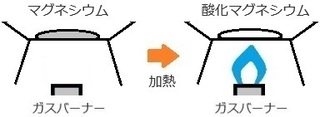
��j�}�O�l�V�E�������M���ċ�C���̎_�f�Ɣ���������ƁA
�_���}�O�l�V�E�����ł���B
(�P) ���������w����
�E������������ �c �}�O�l�V�E���FMg�@�@�_�f�FO�Q
�E������������ �c �_���}�O�l�V�E���FMgO
�_���́A��{�I�ɋ����Ǝ_�f�̔����ł��邱�Ƃ��������Ă����܂��傤�B
(�Q) ���w������
�QMg�{O2�@���@�QMgO
���̎_���Ɠ����ŁA
�}�O�l�V�E��Mg�Ǝ_���}�O�l�V�E��MgO�̑O�ɂQ��t���Đ����킹���܂��B
(�R) �����̃|�C���g
���ƃ}�O�l�V�E���A�����_���ł��A
�������ɈႢ������܂��B
���́A���M�ɂ���Ď_�����Ȃ��獕���Ȃ邾���ł����A
�}�O�l�V�E���́A�_�����Ȃ�������M���Ȃ��甽�����܂��B
���̂悤�ɁA����M���Ȃ���_������ω����A�R���ƌ����܂��B
(�S) ���̃|�C���g
���ӂ��Ă��������|�C���g�́A�_�����̐F�ł��B
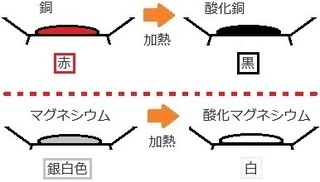
��}�ɂ����t���ŐF�������܂����B
�������_�����������̐F�͍����قƂ�ǂȂ̂ŁA
�_���}�O�l�V�E���̔��͂ƂĂ��������ł��B
���ƊԈ���Ċo���Ȃ��悤�ɒ��ӂ��܂��傤�B
�ł́A�_���̃|�C���g�͂R�B
�@ ���w�����Ⴄ�������������̍����͓���
�A �R���́A����M���Ď_�����鉻�w�ω�
�B �_���������A�_���}�O�l�V�E������
���������ƃ}�O�l�V�E�����قȂ邾���ŁA
���ʓ_�������_�����܂Ƃ߂Ă݂܂����B
�c���A�}�O�l�V�E���́A
�R�ĂƂ��������������E�_���������F
�Ƃ����e�X�g�ɏo�₷���|�C���g���������̂ŁA
�������ԈႢ���Ȃ��悤�Ɋo���Ă��������ˁB
�����̈Ⴂ�ɒ��ӂ��Ȃ���A
���w�ω��E�_���A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
����͉��w�ω��̂Q��ځA�_���̃|�C���g�ł��B
�P��ڂ̉����Ɠ����悤�ɁA
�|�C���g���i���Ă܂Ƃ߂Ă����܂��B
�܂��͕��K����B
�_���Ƃ́A�������_�f�ƌ��т������ŁA
�_���ɂ���Ăł����������_�����ƌ����܂��B
�ł́A������������Ă����܂��傤�B
��j�������M���ċ�C���̎_�f�Ɣ���������ƁA
�_�������ł���B

(�P) ���������w����
�E������������ �c ���FCu�@�@�_�f�FO�Q
�E������������ �c �_�����FCuO
�_���́A��{�I�ɋ����Ǝ_�f�̔����ł��邱�Ƃ��������Ă����܂��傤�B
(�Q) ���w������
�QCu�{O2�@���@�QCuO
��Cu�Ǝ_����CuO�̑O�ɂQ��t���Đ����킹���܂��B
(�R) �����̃|�C���g�@(�S) ���̃|�C���g�́A���R�����Č�قǁB
����́A�_���̗�������P�B
��j�}�O�l�V�E�������M���ċ�C���̎_�f�Ɣ���������ƁA
�_���}�O�l�V�E�����ł���B

(�P) ���������w����
�E������������ �c �}�O�l�V�E���FMg�@�@�_�f�FO�Q
�E������������ �c �_���}�O�l�V�E���FMgO
�_���́A��{�I�ɋ����Ǝ_�f�̔����ł��邱�Ƃ��������Ă����܂��傤�B
(�Q) ���w������
�QMg�{O2�@���@�QMgO
���̎_���Ɠ����ŁA
�}�O�l�V�E��Mg�Ǝ_���}�O�l�V�E��MgO�̑O�ɂQ��t���Đ����킹���܂��B
(�R) �����̃|�C���g
���ƃ}�O�l�V�E���A�����_���ł��A
�������ɈႢ������܂��B
���́A���M�ɂ���Ď_�����Ȃ��獕���Ȃ邾���ł����A
�}�O�l�V�E���́A�_�����Ȃ�������M���Ȃ��甽�����܂��B
���̂悤�ɁA����M���Ȃ���_������ω����A�R���ƌ����܂��B
(�S) ���̃|�C���g
���ӂ��Ă��������|�C���g�́A�_�����̐F�ł��B

��}�ɂ����t���ŐF�������܂����B
�������_�����������̐F�͍����قƂ�ǂȂ̂ŁA
�_���}�O�l�V�E���̔��͂ƂĂ��������ł��B
���ƊԈ���Ċo���Ȃ��悤�ɒ��ӂ��܂��傤�B
�ł́A�_���̃|�C���g�͂R�B
�@ ���w�����Ⴄ�������������̍����͓���
�A �R���́A����M���Ď_�����鉻�w�ω�
�B �_���������A�_���}�O�l�V�E������
���������ƃ}�O�l�V�E�����قȂ邾���ŁA
���ʓ_�������_�����܂Ƃ߂Ă݂܂����B
�c���A�}�O�l�V�E���́A
�R�ĂƂ��������������E�_���������F
�Ƃ����e�X�g�ɏo�₷���|�C���g���������̂ŁA
�������ԈႢ���Ȃ��悤�Ɋo���Ă��������ˁB
�����̈Ⴂ�ɒ��ӂ��Ȃ���A
���w�ω��E�_���A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
2020�N10��24��
�����F�S�Ɨ����͏���ɐi��ł����I
����ɂ��́AYOSHIO�ł��B
���牻�w�ω��Ɉڂ��Ă����܂��B
���̂P��ځA�����̃|�C���g�ł��B
���w����̌㔼��A
�n�[�h�����ł��邾�������āA
������₷���`���悤�܂Ƃ߂Ă����܂��B
�{��ɓ���O�ɁA�����Ƃ͉����H
�����Ƃ́A�������قȂ镨�����m�����т������ŁA
�����ɂ���Ăł����������������ƌ����܂��B
�ł́A���������́A���̗�ł��B
��j�S���Ɨ����̍������������ǂɓ����
�K�X�o�[�i�[�ʼn��M����ƁA�����S���ł���B
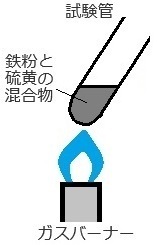
(�P) ���������w����
�܂��́A���͂���K�v�ȕ��������w���ŕ\���܂��B
�@�E�������������� �c �S�FFe�@�@�����FS
�@�E�������������� �c �����S�FFeS
�� ����������I�����W�A��������u���[�́A
(2) �̉��w�������Ƃ������N�����Ă��܂��B
(�Q) ���w������
���ɁA���w�����g�������w�����������������܂��B
�@Fe�{S �� FeS
���肪�������ƂɁA
���w�������͉��w�����Ȃ����킹�邾���Ȃ̂ŁA
�����킹����K�v�͂���܂����B
(�R) �����̃|�C���g
�e�X�g�ɏo�肳���̂́A�@�A�ȊO�ɁA
�����|�C���g���d�v�ł��B
����̉����̏ꍇ���ȒP�Ȑ}�ɂ���ƁA
���̂悤�ɂȂ�A�C���[�W���₷���Ȃ�Ǝv���܂��B
�@�E�����O�F���ɕt��
�@�E�������F�r���ʼn��M���~�߂Ă������͑����Ă���
�@�E������F���ɕt���Ȃ�
�����ł̏d�v�|�C���g�́A
�r���ʼn��M���~�߂Ă������͎~�܂炸�i��ł���
���Ƃł��B
���̃p�^�[���́A���Q���w�ł͂قƂ�ǗႪ�Ȃ��̂ŁA
�S�Ɨ����̔��������Ɗ�����Ċo���������y�ł��B
(�S) ���̃|�C���g
�����O�Ɣ����セ�ꂼ��̎����ǂ����_���������
������ω��������邱�Ƃ��o�肳������Ƃ�����܂��B
�E�����O�ɉ��_�������� �� ���f����������
�E�������ɉ��_�������� �� �������f����������
�������f�́A�����L�i�����������悤�ȏL���j�����܂����A
���̔��������ɏo�Ă�����L�̕\���ł��B
��������悤�ɂ��Ă������Ƃ��A�������߂��܂��B
�ł́A�S�Ɨ����̉����̃|�C���g�͂R�B
�@ ���w���̑g�ݍ��킹�Ŕ����������
�A �������A���M���~�߂Ă������͐i��ł���
�B �������ɉ��_��������������L�̗������f����������
����ȍ~�̉��w�ω��ɂ��Ă�
(�P) ���������w����
(�Q) ���w������
(�R) �����̃|�C���g
(�S) ���̃|�C���g
�̂S�̎��_����|�C���g���������Ă����܂��B
�f�ڂ����}�͊ȒP�ł͂���܂����A�A�A
�����ł��C���[�W�A�b�v�̖��ɗ��Ă���������ł��B
�|�C���g���i��Ȃ���A��ւƂȂ鉻�w�ω����U�߂Ă����̂ŁA
���w�ω��E�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
���牻�w�ω��Ɉڂ��Ă����܂��B
���̂P��ځA�����̃|�C���g�ł��B
���w����̌㔼��A
�n�[�h�����ł��邾�������āA
������₷���`���悤�܂Ƃ߂Ă����܂��B
�{��ɓ���O�ɁA�����Ƃ͉����H
�����Ƃ́A�������قȂ镨�����m�����т������ŁA
�����ɂ���Ăł����������������ƌ����܂��B
�ł́A���������́A���̗�ł��B
��j�S���Ɨ����̍������������ǂɓ����
�K�X�o�[�i�[�ʼn��M����ƁA�����S���ł���B

(�P) ���������w����
�܂��́A���͂���K�v�ȕ��������w���ŕ\���܂��B
�@�E�������������� �c �S�FFe�@�@�����FS
�@�E�������������� �c �����S�FFeS
�� ����������I�����W�A��������u���[�́A
(2) �̉��w�������Ƃ������N�����Ă��܂��B
(�Q) ���w������
���ɁA���w�����g�������w�����������������܂��B
�@Fe�{S �� FeS
���肪�������ƂɁA
���w�������͉��w�����Ȃ����킹�邾���Ȃ̂ŁA
�����킹����K�v�͂���܂����B
(�R) �����̃|�C���g
�e�X�g�ɏo�肳���̂́A�@�A�ȊO�ɁA
�����|�C���g���d�v�ł��B
����̉����̏ꍇ���ȒP�Ȑ}�ɂ���ƁA
���̂悤�ɂȂ�A�C���[�W���₷���Ȃ�Ǝv���܂��B

�@�E�����O�F���ɕt��
�@�E�������F�r���ʼn��M���~�߂Ă������͑����Ă���
�@�E������F���ɕt���Ȃ�
�����ł̏d�v�|�C���g�́A
�r���ʼn��M���~�߂Ă������͎~�܂炸�i��ł���
���Ƃł��B
���̃p�^�[���́A���Q���w�ł͂قƂ�ǗႪ�Ȃ��̂ŁA
�S�Ɨ����̔��������Ɗ�����Ċo���������y�ł��B
(�S) ���̃|�C���g
�����O�Ɣ����セ�ꂼ��̎����ǂ����_���������
������ω��������邱�Ƃ��o�肳������Ƃ�����܂��B
�E�����O�ɉ��_�������� �� ���f����������
�E�������ɉ��_�������� �� �������f����������
�������f�́A�����L�i�����������悤�ȏL���j�����܂����A
���̔��������ɏo�Ă�����L�̕\���ł��B
��������悤�ɂ��Ă������Ƃ��A�������߂��܂��B
�ł́A�S�Ɨ����̉����̃|�C���g�͂R�B
�@ ���w���̑g�ݍ��킹�Ŕ����������
�A �������A���M���~�߂Ă������͐i��ł���
�B �������ɉ��_��������������L�̗������f����������
����ȍ~�̉��w�ω��ɂ��Ă�
(�P) ���������w����
(�Q) ���w������
(�R) �����̃|�C���g
(�S) ���̃|�C���g
�̂S�̎��_����|�C���g���������Ă����܂��B
�f�ڂ����}�͊ȒP�ł͂���܂����A�A�A
�����ł��C���[�W�A�b�v�̖��ɗ��Ă���������ł��B
�|�C���g���i��Ȃ���A��ւƂȂ鉻�w�ω����U�߂Ă����̂ŁA
���w�ω��E�����A�撣���Ă݂܂��H
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
2020�N10��22��
���Q���w�͎�������݁I
����ɂ��́AYOSHIO�ł��B
����͉��w����̌㔼��Ɍ����āA
����ȍ~�̃u���O�ŃA�b�v������e���A
�O��܂ł̉��w���e�K���Ȃ���
�O�U������Ă����܂��B
�\��Ƃ��ẮA
�@ ���w�����F����
�A ���w�����F�_��
�B ���w�����F�Ҍ�
�C ���w�����F����
�D ���ʕۑ��̖@��
�E ���w�ω��Ǝ��ʌv�Z
�̂U��ɓn���āA��������������
�i�߂Ă����܂��B
���w�̗p��ł���
�����E�_���E�Ҍ��E����
�ɂ��ẮA�P�O���P�R���̃u���O��
�ȒP�ɐ������Ă���̂Ō��Ă݂ĉ������ˁB
�ł́A��������́A��܂��ɗ\���̂悤�Ȍ`����
�@�`�E�܂ł�ǂ��Ă����܂��B
�@ ���w�ω��F����
�c���炭�A���Q���w�ň�ԕ��S�����Ȃ����e���Ǝv���A
�g�b�v�o�b�^�[�ɂ��܂����B
�E�S�Ɨ����̉��w�ω�
�Ő������Ă����܂��B
�e�X�g�ɏo�₷���������e�̃|�C���g��
�܂Ƃ߂Ă����܂��B
�A ���w�ω��F�_��
�����Ǝ_�f�����т����w�����ł��ˁB
�E���̎_��
�E�}�O�l�V�E���̎_��
�����������܂��B
�E�̎��ʌv�Z�ɂ�����ނ̂Œ��ӂł��B
�B ���w�ω��F�Ҍ�
�_��������_�f���藣����锽���ł��B
�E�_�����ƒY�f�ɂ�鉻�w����
�Ő������܂��B
�������s����ł̒��ӓ_���A
�e�X�g���ɕK�v�ɂȂ镔���ł��B
�C ���w�ω��F����
�c�������ł��B
�P�̕������ʂ̕����ɕ�����锽���ł����A
��ނ��L�x�ł��B
�E�Y�_���f�i�g���E���̉��M����
�E�_����̉��M����
�E���̓d�C����
�ƁA���ȏ��ő����̔������o�Ă��܂��B
�|�C���g���i��Ȃ���A�R���p�N�g�ɐ������܂��B
�D���ʕۑ��̖@��
�@�����Ɠ��e���o���邾���Ȃ̂ŁA
�ɒ[�ɑ�ςȂ��Ƃ͂��܂���B
�E ���w�ω��Ǝ��ʌv�Z
�Ō�̍Ō�ɁA���w�v�Z�̓o��ł��B
�ނ���A���܂œo�ꂵ�Ȃ����̂��s�v�c�Ȃ��炢�ł��B
���w�ω��ɕK�v�Ȍv�Z�m������@���A
�����g���Đ������Ă����܂��B
�c�Ƃ�����ɁA��܂��ɁE�ȒP��
����̃u���O�A�b�v���e���Љ�܂����B
�O��܂łɂ��`�����Ă����A
�������E���w���E���w�������E���w�ω�
����g���āA
�P�P���w�ω����U�����Ă����܂��B
�܂��A���͂����ɗ���Ȃ��ŁA
�}�E�\�ȂǕ�����₷���A
�܂����w�����Ȑl�Ƀ|�C���g���i����
���`���ł���悤�ɍH�v���Ă����܂��B
���w�̌㔼��A������肶������i�߂Ă����̂ŁA
�����ڂł��t������������Ɗ������ł��B
�o���邱�Ƃ������Ă��A�P���n�[�h�����z���āA
���w�̌㔼��A�撣���Ă݂܂��H
����͉��w����̌㔼��Ɍ����āA
����ȍ~�̃u���O�ŃA�b�v������e���A
�O��܂ł̉��w���e�K���Ȃ���
�O�U������Ă����܂��B
�\��Ƃ��ẮA
�@ ���w�����F����
�A ���w�����F�_��
�B ���w�����F�Ҍ�
�C ���w�����F����
�D ���ʕۑ��̖@��
�E ���w�ω��Ǝ��ʌv�Z
�̂U��ɓn���āA��������������
�i�߂Ă����܂��B
���w�̗p��ł���
�����E�_���E�Ҍ��E����
�ɂ��ẮA�P�O���P�R���̃u���O��
�ȒP�ɐ������Ă���̂Ō��Ă݂ĉ������ˁB
�ł́A��������́A��܂��ɗ\���̂悤�Ȍ`����
�@�`�E�܂ł�ǂ��Ă����܂��B
�@ ���w�ω��F����
�c���炭�A���Q���w�ň�ԕ��S�����Ȃ����e���Ǝv���A
�g�b�v�o�b�^�[�ɂ��܂����B
�E�S�Ɨ����̉��w�ω�
�Ő������Ă����܂��B
�e�X�g�ɏo�₷���������e�̃|�C���g��
�܂Ƃ߂Ă����܂��B
�A ���w�ω��F�_��
�����Ǝ_�f�����т����w�����ł��ˁB
�E���̎_��
�E�}�O�l�V�E���̎_��
�����������܂��B
�E�̎��ʌv�Z�ɂ�����ނ̂Œ��ӂł��B
�B ���w�ω��F�Ҍ�
�_��������_�f���藣����锽���ł��B
�E�_�����ƒY�f�ɂ�鉻�w����
�Ő������܂��B
�������s����ł̒��ӓ_���A
�e�X�g���ɕK�v�ɂȂ镔���ł��B
�C ���w�ω��F����
�c�������ł��B
�P�̕������ʂ̕����ɕ�����锽���ł����A
��ނ��L�x�ł��B
�E�Y�_���f�i�g���E���̉��M����
�E�_����̉��M����
�E���̓d�C����
�ƁA���ȏ��ő����̔������o�Ă��܂��B
�|�C���g���i��Ȃ���A�R���p�N�g�ɐ������܂��B
�D���ʕۑ��̖@��
�@�����Ɠ��e���o���邾���Ȃ̂ŁA
�ɒ[�ɑ�ςȂ��Ƃ͂��܂���B
�E ���w�ω��Ǝ��ʌv�Z
�Ō�̍Ō�ɁA���w�v�Z�̓o��ł��B
�ނ���A���܂œo�ꂵ�Ȃ����̂��s�v�c�Ȃ��炢�ł��B
���w�ω��ɕK�v�Ȍv�Z�m������@���A
�����g���Đ������Ă����܂��B
�c�Ƃ�����ɁA��܂��ɁE�ȒP��
����̃u���O�A�b�v���e���Љ�܂����B
�O��܂łɂ��`�����Ă����A
�������E���w���E���w�������E���w�ω�
����g���āA
�P�P���w�ω����U�����Ă����܂��B
�܂��A���͂����ɗ���Ȃ��ŁA
�}�E�\�ȂǕ�����₷���A
�܂����w�����Ȑl�Ƀ|�C���g���i����
���`���ł���悤�ɍH�v���Ă����܂��B
���w�̌㔼��A������肶������i�߂Ă����̂ŁA
�����ڂł��t������������Ɗ������ł��B
�o���邱�Ƃ������Ă��A�P���n�[�h�����z���āA
���w�̌㔼��A�撣���Ă݂܂��H
2020�N10��21��
�u���C�N�F���̊撣��͂������I
����ɂ��́AYOSHIO�ł��B
�������u���O���{�������A
�{���ɂ��肪�Ƃ��������܂��I
�O��u���O�̉��w�������܂ł�
���w����̔������I����ꂽ�����Ȃ̂ŁA
���t���b�V�����Ă�u���C�N�ł��B
�c�����B�{���ɁA�����B
���P���ȂƈႢ�A
���Q���Ȃ͂P�̒P�����e���d���������߁A
�𑝂₵�ĕ�����₷�����̂�
�A�b�v���Ă����`���ɂȂ��Ă��܂��B
�P�P���߂��ɂȂ��Ă��āA
�C����������A�������Ȃ��Ă��܂������A
�̒�������Ȃ��悤�ɉ߂����Ă����������̂ł��ˁB
���ɁA�P�O���㔼�ɓ���ƁA
���R���ɂƂ��ẮA
�e�X�g�̌��ʂ����łȂ��A
�u�]�Z�̌���ɂ��M�����鍠�ɂȂ�܂��B
�ƒ���Őe�ƌ��P���J�ɂȂ�����A
�w�Z�ł̎O�Җʒk�Ƀh�L�h�L������A
�����Ɨ��������Ȃ����X�������Ă��܂��B
���ɁA���N�͐V�^�R���i��
�w�K�y�[�X�𗐂�������Ԃɂ��Ȃ��Ă��܂��B
���Ȃ��Ƃ��A���ɗ��ł�����ɂ́A
���N�̏t�ɋg���߂�悤�A
�����ꂵ���Ă���ŏ���悤��
����ꂽ���Ԃ̒��ł��撣���Ăق����z���ł��B
���N�������ɐ����o���p�����Ă��܂������A
���N�����������Ă��܂��B�B�B
�P���ɁA
�B���������ڕW�Ɍ������āA
�l�͑S�͂��o�����
�Ƃ������Ƃ���������u�Ԃł��B
���̂��肪���݂Ƃ������������Ȃ���A
�Ɍ������ēw�͂��Ă��钆�w���E���Z�����A
���N���S�͂ʼn������܂��I
�� ����́A���w����̌㔼��Ɍ��������e��
�ȒP�ɐ������܂��B
�������u���O���{�������A
�{���ɂ��肪�Ƃ��������܂��I
�O��u���O�̉��w�������܂ł�
���w����̔������I����ꂽ�����Ȃ̂ŁA
���t���b�V�����Ă�u���C�N�ł��B
�c�����B�{���ɁA�����B
���P���ȂƈႢ�A
���Q���Ȃ͂P�̒P�����e���d���������߁A
�𑝂₵�ĕ�����₷�����̂�
�A�b�v���Ă����`���ɂȂ��Ă��܂��B
�P�P���߂��ɂȂ��Ă��āA
�C����������A�������Ȃ��Ă��܂������A
�̒�������Ȃ��悤�ɉ߂����Ă����������̂ł��ˁB
���ɁA�P�O���㔼�ɓ���ƁA
���R���ɂƂ��ẮA
�e�X�g�̌��ʂ����łȂ��A
�u�]�Z�̌���ɂ��M�����鍠�ɂȂ�܂��B
�ƒ���Őe�ƌ��P���J�ɂȂ�����A
�w�Z�ł̎O�Җʒk�Ƀh�L�h�L������A
�����Ɨ��������Ȃ����X�������Ă��܂��B
���ɁA���N�͐V�^�R���i��
�w�K�y�[�X�𗐂�������Ԃɂ��Ȃ��Ă��܂��B
���Ȃ��Ƃ��A���ɗ��ł�����ɂ́A
���N�̏t�ɋg���߂�悤�A
�����ꂵ���Ă���ŏ���悤��
����ꂽ���Ԃ̒��ł��撣���Ăق����z���ł��B
���N�������ɐ����o���p�����Ă��܂������A
���N�����������Ă��܂��B�B�B
�P���ɁA
�B���������ڕW�Ɍ������āA
�l�͑S�͂��o�����
�Ƃ������Ƃ���������u�Ԃł��B
���̂��肪���݂Ƃ������������Ȃ���A
�Ɍ������ēw�͂��Ă��钆�w���E���Z�����A
���N���S�͂ʼn������܂��I
�� ����́A���w����̌㔼��Ɍ��������e��
�ȒP�ɐ������܂��B
2020�N10��20��
�������͊o���₷�����̂���U�߂�I
����ɂ��́AYOSHIO�ł��B
����͉��w�̂W��ځA���w�������ł����A
�O��̑����ł���
(�Q) ���w�������̗�
�ł��B
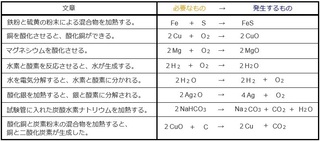
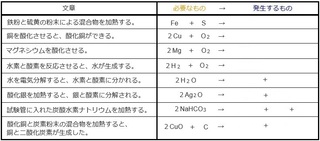
����́A���Q���Ȃŏo�Ă��鉻�w�������𒆐S�ɂ܂Ƃ߂Ă����܂��B
�c�O��u���O���{�������������F�l�A
���t�������{���ɂ��肪�Ƃ��������܂����I
�ǂݏI�������ŁA
�u��ꂽ�c�I�v
�ƁA�Ԃ₢���l���������������̂ł́c�H
����́A�O��̂悤�ȓ���b�͔����ɂ��āA
�o���Ă����ׂ����Q���Ȃ̉��w������
�Ƃ��āA�ꗗ�ɂ������̂��A�b�v���܂��B
�c�����A��߂Ă���c�B
�������w�������́A���O�����c�B
���̂悤�ɁA���Ȃ肽�����Ȃ�܂���ˁc�B
�����ł�����߂�̂͏����҂��Ă��������I
���͂��̕\�ɂق�̏��������H�v�������Ă݂܂����B
���ɁA�\�̉E��ɒ��ڂ��Ă��炦��Ɗ������ł��B
���w���������܂Ƃ߂����Ԃ́A
���ȏ��ɍڂ��Ă��鏇�Ԃł͂���܂���B
�����v�������ł��o���镉�S���}�V�ɂȂ�悤�A
���ёւ������̂ł��B
�܂���S�i�́A�Q�̕����������āA�P�ɂ��������B
�ォ�珇�ɁA�������u�Q�v�����t����������������܂����B
�i�������� �� �Q������������ �� H2O�ɂ��u�Q�v�j
�������i�̐��Ǝ_�����́A�P�̕������A�Q�ɕ����������B
Ag�����u�S�v�ɂȂ�̂́A�v�����ł��B
�Ō�����Q�i�͏����ς�����^�C�v�B
�P���R�ɕ����ꂽ��A
�Q�̕�����������ɕʂ̂Q�̕����ɂȂ�����B
�v�́A��������E�o���ɂ����������ł��B
�o����菇�́A�ЂƂ܂����ォ�珇�Ԃő��v�ł��B
�������A�����͋֕��ł��B
��C�ɂ�낤�Ƃ���ƁA���C���N����܂���A
�������P���m���Ɋo���Ă����܂��傤�B
�Ⴆ�A
���w���������P���ɂP�͏�����悤�ɂ���I
�Ƃ������ڕW�𗧂Ă�̂��������߂ł��B
�������A���w����������Ɗo���Ă������Ƃ��K�v�Ȃ̂ŁA
�o���Y�ꂪ��������A�o�������Α��v�ł�����ˁB
����̉��w�������́A
����ȍ~�̉��w�����̐����ɕK�v�Ȃ��̂���Ȃ̂ŁA
���X�ƍ���o�ꂵ�܂��B
���ڂɂ����������Ɋo�����Ă��邩�s���Ȏ��́A
�o�������ɗ͂𒍂��ł݂Ă��������B
�o���邱�Ƃ������Ă��A�P���ςݏd�˂āA
���w�������A�撣���Ă݂܂��H
�� ���K�p��m�F�p�ɍ쐬���Ă݂܂����B
(�P) �K�v�Ȃ��̂߂�^�C�v

(�Q) ����������̂߂�^�C�v
(�R) �S�����߂�^�C�v
����x�ɍ��킹�Ďg���Ă݂Ă��������ˁB
����͉��w�̂W��ځA���w�������ł����A
�O��̑����ł���
(�Q) ���w�������̗�
�ł��B
����́A���Q���Ȃŏo�Ă��鉻�w�������𒆐S�ɂ܂Ƃ߂Ă����܂��B
�c�O��u���O���{�������������F�l�A
���t�������{���ɂ��肪�Ƃ��������܂����I
�ǂݏI�������ŁA
�u��ꂽ�c�I�v
�ƁA�Ԃ₢���l���������������̂ł́c�H
����́A�O��̂悤�ȓ���b�͔����ɂ��āA
�o���Ă����ׂ����Q���Ȃ̉��w������
�Ƃ��āA�ꗗ�ɂ������̂��A�b�v���܂��B

�c�����A��߂Ă���c�B
�������w�������́A���O�����c�B
���̂悤�ɁA���Ȃ肽�����Ȃ�܂���ˁc�B
�����ł�����߂�̂͏����҂��Ă��������I
���͂��̕\�ɂق�̏��������H�v�������Ă݂܂����B
���ɁA�\�̉E��ɒ��ڂ��Ă��炦��Ɗ������ł��B
���w���������܂Ƃ߂����Ԃ́A
���ȏ��ɍڂ��Ă��鏇�Ԃł͂���܂���B
�����v�������ł��o���镉�S���}�V�ɂȂ�悤�A
���ёւ������̂ł��B
�܂���S�i�́A�Q�̕����������āA�P�ɂ��������B
�ォ�珇�ɁA�������u�Q�v�����t����������������܂����B
�i�������� �� �Q������������ �� H2O�ɂ��u�Q�v�j
�������i�̐��Ǝ_�����́A�P�̕������A�Q�ɕ����������B
Ag�����u�S�v�ɂȂ�̂́A�v�����ł��B
�Ō�����Q�i�͏����ς�����^�C�v�B
�P���R�ɕ����ꂽ��A
�Q�̕�����������ɕʂ̂Q�̕����ɂȂ�����B
�v�́A��������E�o���ɂ����������ł��B
�o����菇�́A�ЂƂ܂����ォ�珇�Ԃő��v�ł��B
�������A�����͋֕��ł��B
��C�ɂ�낤�Ƃ���ƁA���C���N����܂���A
�������P���m���Ɋo���Ă����܂��傤�B
�Ⴆ�A
���w���������P���ɂP�͏�����悤�ɂ���I
�Ƃ������ڕW�𗧂Ă�̂��������߂ł��B
�������A���w����������Ɗo���Ă������Ƃ��K�v�Ȃ̂ŁA
�o���Y�ꂪ��������A�o�������Α��v�ł�����ˁB
����̉��w�������́A
����ȍ~�̉��w�����̐����ɕK�v�Ȃ��̂���Ȃ̂ŁA
���X�ƍ���o�ꂵ�܂��B
���ڂɂ����������Ɋo�����Ă��邩�s���Ȏ��́A
�o�������ɗ͂𒍂��ł݂Ă��������B
�o���邱�Ƃ������Ă��A�P���ςݏd�˂āA
���w�������A�撣���Ă݂܂��H
�� ���K�p��m�F�p�ɍ쐬���Ă݂܂����B
(�P) �K�v�Ȃ��̂߂�^�C�v

(�Q) ����������̂߂�^�C�v

(�R) �S�����߂�^�C�v

����x�ɍ��킹�Ďg���Ă݂Ă��������ˁB
���w�������������́A���͂��������I
����ɂ��́AYOSHIO�ł��B
����͉��w�̂V��ځA���w�������ł��B
���Q���w�̃��C���C�x���g�ƌ����Ă��ߌ��ł͂Ȃ��A
�O��܂ł̉��w������g���āA
���w�����������܂��B
�c�����A�P��ł܂Ƃ߂ăA�b�v����ɂ́A
�������̍������A����A
���荞��ł����Ɨe�ʂ������܂����Ȃ����̂ŁA
�Q��ɕ����ăA�b�v���Ă����܂��B
�i����ɂ��Ȃ��킵�A�A�b�v�܂łɎ��Ԃ�������c�B�j
�Q��ɕ�������e�͎��̒ʂ�ŁA
(�P) ���w�������ƍ���
(�Q) ���w�������̗�
�ł��B
����͍����𒆐S�ɂ܂Ƃ߂Ă����܂��B
�c�{���ɁA���̉��w�������ݏo�����l�����́A�̂��ł��B
�c�����A�������̉��w���������w�K�������́A
�u�ǂ����Ă���Ȃ��̂��o���Ȃ���c�v
�ƕ�����悭�����Ă����L��������܂��c�B
�����A���̎���ł��A
�m�����������������s�����ڂ��Ă���̂����ẮA
����͌J��Ԃ��Ȃ��c�Ƃ��݂��ݎv���܂��B
�������w�������̍����ɂ��Ăł��B
���w������������������͎��̂悤�ɏo�肳��܂��B
��j�����_�����������̉��w�������������Ȃ����B
��j���́i�@�@�j�ɉ��w���Ă͂߂ĉ��w�����������������Ȃ����B
�@�@�i�@�@�j�{�i�@�@�j���@�QCu�@�{�@CO�Q
�e�X�g�����ł͂Ȃ��A���Z�����ł��o�肳����قǂȂ̂ŁA
������ɉz�������Ƃ͂���܂���B
�c���A�����ȒP�Ɍ����Ă��A�A�A
�ǂ������菇�ʼn��w�����������悢���A�A�A
�w�Z�̎��Ƃ��Ă�������Ȃ����Ƃ�����܂��B
�ł́A���w������������ł̎菇�ƂȂ�|�C���g��
��ɉ������Ă����܂��傤�B
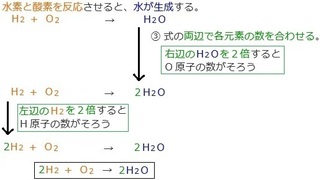
�@ ���͂����K�v�ȉ��w������������B
�A ���ӂ͉��w�������K�v�Ȃ����A
�@ �E�ӂ�������������ŕ�����B
�B ���̗��ӂ��e���f�̐������킹���B
�i�����̐F�����ɂ��ẮA�摜�̉��H�Ɗ֘A���Ă��܂��j
������Q�̉��w�����̗��������̂ŁA
�R�̃|�C���g�ɉ����Đ������Ă����܂��ˁB
��P�j���f�Ǝ_�f��������ƁA������������B
���͂��牻�w�����������̂ŁA

���w�����ɂ́A���������镨��������A
������ɔ������镨��������̂ŁA
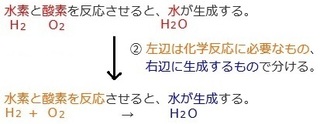
�����A���̂܂܉��w������ׂ������ł̓_���Ȃ̂ŁA
����ʼn��w�������͊����ł��B
���w���̑O�ɐ���u���A
�����Z���Ȃ��琔���킹����̂ɁA��J���܂��B
���̕��@�́A���Z���w�ł����p�ł�����@�Ȃ̂ŁA
���n�u�]�̐l�͂ł���悤�ɂȂ��Ă����Ɨǂ��ł��B
�ʂ̗�������P�B
��Q�j�S���Ɨ����̕����ɂ�鍬���������M����B
���͂��牻�w�����������̂ŁA

���w�����ɂ́A���������镨��������A
������ɔ������镨��������܂��B
�����A����̂悤���������������
����������Ȃ����邢�ꍇ������܂��B

����͂��̂܂܂P�̎��ɂȂ��邾���ŗǂ��ꍇ������܂��B
�ł́A���w�����������|�C���g�͂R�B
�@ ���͂����K�v�ȉ��w������������
�A ���ӂ͉��w�������K�v�Ȃ����A
�@ �E�ӂ�������������ŕ�����
�B ���̗��ӂ��e���f�̐������킹��
�������́A�菇��ǂ��Ȃ���P���N���A�ł���悤
���K���d�˂Ă����܂��傤�B
��������A�܂��o������Ă��Ȃ����w�����ǂꂩ�A
�ɂ��C���t���܂�����ˁB
���͂���q���g����������T��o���āA
���w�������A�撣���Ă݂܂��H
�� ����́A(�Q) ���w�������̗��ł��B
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB
����͉��w�̂V��ځA���w�������ł��B
���Q���w�̃��C���C�x���g�ƌ����Ă��ߌ��ł͂Ȃ��A
�O��܂ł̉��w������g���āA
���w�����������܂��B
�c�����A�P��ł܂Ƃ߂ăA�b�v����ɂ́A
�������̍������A����A
���荞��ł����Ɨe�ʂ������܂����Ȃ����̂ŁA
�Q��ɕ����ăA�b�v���Ă����܂��B
�i����ɂ��Ȃ��킵�A�A�b�v�܂łɎ��Ԃ�������c�B�j
�Q��ɕ�������e�͎��̒ʂ�ŁA
(�P) ���w�������ƍ���
(�Q) ���w�������̗�
�ł��B
����͍����𒆐S�ɂ܂Ƃ߂Ă����܂��B
�c�{���ɁA���̉��w�������ݏo�����l�����́A�̂��ł��B
�c�����A�������̉��w���������w�K�������́A
�u�ǂ����Ă���Ȃ��̂��o���Ȃ���c�v
�ƕ�����悭�����Ă����L��������܂��c�B
�����A���̎���ł��A
�m�����������������s�����ڂ��Ă���̂����ẮA
����͌J��Ԃ��Ȃ��c�Ƃ��݂��ݎv���܂��B
�������w�������̍����ɂ��Ăł��B
���w������������������͎��̂悤�ɏo�肳��܂��B
��j�����_�����������̉��w�������������Ȃ����B
��j���́i�@�@�j�ɉ��w���Ă͂߂ĉ��w�����������������Ȃ����B
�@�@�i�@�@�j�{�i�@�@�j���@�QCu�@�{�@CO�Q
�e�X�g�����ł͂Ȃ��A���Z�����ł��o�肳����قǂȂ̂ŁA
������ɉz�������Ƃ͂���܂���B
�c���A�����ȒP�Ɍ����Ă��A�A�A
�ǂ������菇�ʼn��w�����������悢���A�A�A
�w�Z�̎��Ƃ��Ă�������Ȃ����Ƃ�����܂��B
�ł́A���w������������ł̎菇�ƂȂ�|�C���g��
��ɉ������Ă����܂��傤�B
�@ ���͂����K�v�ȉ��w������������B
�A ���ӂ͉��w�������K�v�Ȃ����A
�@ �E�ӂ�������������ŕ�����B
�B ���̗��ӂ��e���f�̐������킹���B
�i�����̐F�����ɂ��ẮA�摜�̉��H�Ɗ֘A���Ă��܂��j
������Q�̉��w�����̗��������̂ŁA
�R�̃|�C���g�ɉ����Đ������Ă����܂��ˁB
��P�j���f�Ǝ_�f��������ƁA������������B
���͂��牻�w�����������̂ŁA

���w�����ɂ́A���������镨��������A
������ɔ������镨��������̂ŁA

�����A���̂܂܉��w������ׂ������ł̓_���Ȃ̂ŁA

����ʼn��w�������͊����ł��B
���w���̑O�ɐ���u���A
�����Z���Ȃ��琔���킹����̂ɁA��J���܂��B
���̕��@�́A���Z���w�ł����p�ł�����@�Ȃ̂ŁA
���n�u�]�̐l�͂ł���悤�ɂȂ��Ă����Ɨǂ��ł��B
�ʂ̗�������P�B
��Q�j�S���Ɨ����̕����ɂ�鍬���������M����B
���͂��牻�w�����������̂ŁA

���w�����ɂ́A���������镨��������A
������ɔ������镨��������܂��B
�����A����̂悤���������������
����������Ȃ����邢�ꍇ������܂��B

����͂��̂܂܂P�̎��ɂȂ��邾���ŗǂ��ꍇ������܂��B
�ł́A���w�����������|�C���g�͂R�B
�@ ���͂����K�v�ȉ��w������������
�A ���ӂ͉��w�������K�v�Ȃ����A
�@ �E�ӂ�������������ŕ�����
�B ���̗��ӂ��e���f�̐������킹��
�������́A�菇��ǂ��Ȃ���P���N���A�ł���悤
���K���d�˂Ă����܂��傤�B
��������A�܂��o������Ă��Ȃ����w�����ǂꂩ�A
�ɂ��C���t���܂�����ˁB
���͂���q���g����������T��o���āA
���w�������A�撣���Ă݂܂��H
�� ����́A(�Q) ���w�������̗��ł��B
��R�����g�L����
���z�⎿��ȂǁA�C�y�ɃR�����g����OK�ł��B
�E�����O�F�y���l�[����OK
�E�R�����g
���L�����邾���ō\���܂���ˁB