新規記事の投稿を行うことで、非表示にすることが可能です。
2020年09月30日
溶解度はグラフの移り変わりに要注意!Part.2
こんにちは、YOSHIOです。
今回は物質の8回目、溶解度Part.2です。
前回の溶解度Part.1を引用しながら、
実際に溶解度の計算問題を扱ってみます。
Part.1の結びでも触れましたが、
決して焦らずに、じっくり理解していきましょう。
では早速、溶解度の基本問題を1つ。
例)下グラフは、硝酸カリウムと塩化ナトリウムの溶解度の
変化を表したものである。
(1) 40℃の水100gに硝酸カリウムを何g溶かせるか。
(2) 40℃の水200gに硝酸カリウムは何g溶かせるか。
(3) 40℃の水100gに硝酸カリウム45g溶かした水溶液を
20℃まで冷やした時、硝酸カリウムは何g取り出せるか。
(4) (3)のように、水に溶かした溶質を再び固体として取り出すことを
何というか。
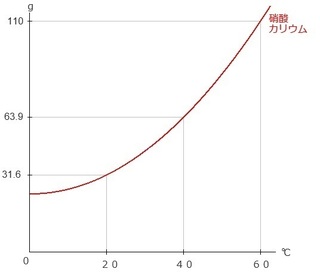
(1) 水100gに溶かせる量は溶解度のことなので、
下のグラフの●からそのまま横軸を見て、63.9g
(2) 水が200gと量が変化した場合の溶かせる量は、
比例式を使うと楽に解けます。
水200gに溶かす硝酸カリウムをXgとすると、
水200g:硝酸カリウムXg
グラフから分かる溶解度から、
水100g:硝酸カリウム63.9g
より、「=」でつなぐと、
200:X=100:63.9
で式をつないで解きます。
X=123.8g
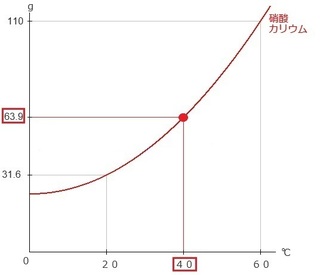
(3) 40℃から20℃への温度変化が出てきたら、
そのまま下のようにスライドさせます。
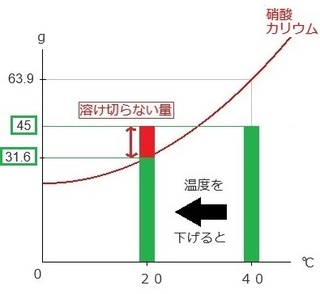
ところが、グラフの上にはみ出す赤棒部分は、
冷やされることで硝酸カリウムの固体を再び取り出せる
状態になります。
(溶かした量)-(下げた温度での溶解度) より、
45g-31.6g=13.4g
(4) 再び固体を取り出す方法は、再結晶と言います。
キーワードは、再び固体(結晶)を取り出すです。
では、溶解度の計算のポイントは3つ。
① 同じ温度での量の変化は、比例式で解く
② 温度変化はそのままスライドさせる
③ 再結晶は、溶かした溶質を再び取り出す方法
溶解度の計算だけに限らず、
折角条件で出てきたグラフを利用せずに、
計算をやってしまおうとする人もいます。
けれども、文章と同じく出題されているのであれば、
大いに利用して解くべきだ! ということなので、
しっかりグラフに書き込みなどをすることで、
問題文章がグラフのどの部分を指すかをつかむ
ことにつながりますからね。
2回に渡って溶解度の計算を扱いました。
あくまで基本問題ですが、
自力で解けるための手立てになると嬉しいです。
グラフの使い方を練習して、
溶解度の計算、頑張ってみませんか?
※ 焦らなくていいから、じっくり!しっかりと!
≪コメント記入≫
感想や質問など、気軽にコメントしてOKです。
・お名前:ペンネームでOK
・コメント
を記入するだけで構いませんからね。
今回は物質の8回目、溶解度Part.2です。
前回の溶解度Part.1を引用しながら、
実際に溶解度の計算問題を扱ってみます。
Part.1の結びでも触れましたが、
決して焦らずに、じっくり理解していきましょう。
では早速、溶解度の基本問題を1つ。
例)下グラフは、硝酸カリウムと塩化ナトリウムの溶解度の
変化を表したものである。
(1) 40℃の水100gに硝酸カリウムを何g溶かせるか。
(2) 40℃の水200gに硝酸カリウムは何g溶かせるか。
(3) 40℃の水100gに硝酸カリウム45g溶かした水溶液を
20℃まで冷やした時、硝酸カリウムは何g取り出せるか。
(4) (3)のように、水に溶かした溶質を再び固体として取り出すことを
何というか。

(1) 水100gに溶かせる量は溶解度のことなので、
下のグラフの●からそのまま横軸を見て、63.9g

(2) 水が200gと量が変化した場合の溶かせる量は、
比例式を使うと楽に解けます。
水200gに溶かす硝酸カリウムをXgとすると、
水200g:硝酸カリウムXg
グラフから分かる溶解度から、
水100g:硝酸カリウム63.9g
より、「=」でつなぐと、
200:X=100:63.9
で式をつないで解きます。
X=123.8g
(3) 40℃から20℃への温度変化が出てきたら、
そのまま下のようにスライドさせます。

ところが、グラフの上にはみ出す赤棒部分は、
冷やされることで硝酸カリウムの固体を再び取り出せる
状態になります。
(溶かした量)-(下げた温度での溶解度) より、
45g-31.6g=13.4g
(4) 再び固体を取り出す方法は、再結晶と言います。
キーワードは、再び固体(結晶)を取り出すです。
では、溶解度の計算のポイントは3つ。
① 同じ温度での量の変化は、比例式で解く
② 温度変化はそのままスライドさせる
③ 再結晶は、溶かした溶質を再び取り出す方法
溶解度の計算だけに限らず、
折角条件で出てきたグラフを利用せずに、
計算をやってしまおうとする人もいます。
けれども、文章と同じく出題されているのであれば、
大いに利用して解くべきだ! ということなので、
しっかりグラフに書き込みなどをすることで、
問題文章がグラフのどの部分を指すかをつかむ
ことにつながりますからね。
2回に渡って溶解度の計算を扱いました。
あくまで基本問題ですが、
自力で解けるための手立てになると嬉しいです。
グラフの使い方を練習して、
溶解度の計算、頑張ってみませんか?
※ 焦らなくていいから、じっくり!しっかりと!
≪コメント記入≫
感想や質問など、気軽にコメントしてOKです。
・お名前:ペンネームでOK
・コメント
を記入するだけで構いませんからね。