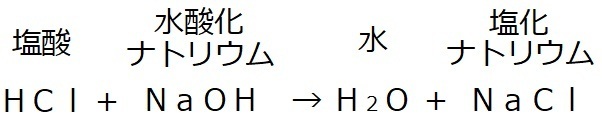新規記事の投稿を行うことで、非表示にすることが可能です。
2022年03月11日
ダニエル電池…今度はダニエルか!?
こんにちは、YOSHIOです。
今回は電池編の4回目・ダニエル電池です。
ボルタとは、一次電池を発明したイギリスの化学者。
このダニエルさんが発明した一次電池が、ダニエル電池です。
今回は、ダニエル電池とボルタ電池の違い
を簡単にまとめていきます。
復習までに、
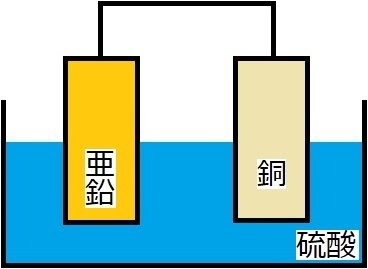
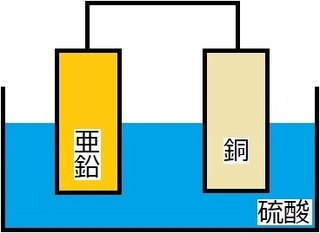
前回のボルタ電池の御登場!
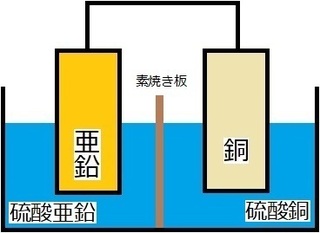
続いて、今回の主役・ダニエル電池にも
登場してもらいましょう!
…何が違うの?
見た目はよく似ているけれど…
正直、よく似たものを並べられると、
覚え間違いをしそうで怖いもの…
そこで、ボルタ電池とダニエル電池の違いを
下のようにまとめてみました。
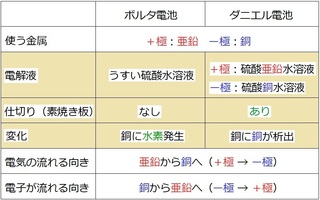
発明者は違っても、
同じ一次電池の仲間なので、
・使う金属
・電流や電子が流れる向き
は同じです。
そこで、注意すべきは、
ボルタ電池とダニエル電池の違う点です。
ボルタ電池は、
・電解液は硫酸のみ
・素焼き板はなし
・銅板に水素が発生
ダニエル電池では、
・電解液は硫酸亜鉛と硫酸銅の2つ
・素焼き板はあり
・銅板に銅が付着する
この3点の違いは、
覚え間違いしないことが重要です。
…と言うのは簡単ですが、
前回のボルタ電池と合わせて、
覚えることが急激に増えています。
一つ一つ覚えるには、
時間とエネルギーが必要なので、
上記のようにまとめて、
最低限必要なポイントを初めに押さえておきましょう。
では、ダニエル電池のポイントは3つ。
① 電解液は硫酸亜鉛と硫酸銅の2つ!
② 素焼き板で仕切りがある!
③ 銅板に銅が付着する!
ひとまず、一次電池は、
ボルタ電池とダニエル電池の2つを
押さえておくだけでも十分です。
次回は、二次電池と燃料電池を簡単に説明して、
電池分野も一区切りです。
ボルタ電池との違いを区別して、
ダニエル電池、頑張ってみませんか?
今回は電池編の4回目・ダニエル電池です。
ボルタとは、一次電池を発明したイギリスの化学者。
このダニエルさんが発明した一次電池が、ダニエル電池です。
今回は、ダニエル電池とボルタ電池の違い
を簡単にまとめていきます。
復習までに、
前回のボルタ電池の御登場!

続いて、今回の主役・ダニエル電池にも
登場してもらいましょう!

…何が違うの?
見た目はよく似ているけれど…
正直、よく似たものを並べられると、
覚え間違いをしそうで怖いもの…
そこで、ボルタ電池とダニエル電池の違いを
下のようにまとめてみました。

発明者は違っても、
同じ一次電池の仲間なので、
・使う金属
・電流や電子が流れる向き
は同じです。
そこで、注意すべきは、
ボルタ電池とダニエル電池の違う点です。
ボルタ電池は、
・電解液は硫酸のみ
・素焼き板はなし
・銅板に水素が発生
ダニエル電池では、
・電解液は硫酸亜鉛と硫酸銅の2つ
・素焼き板はあり
・銅板に銅が付着する
この3点の違いは、
覚え間違いしないことが重要です。
…と言うのは簡単ですが、
前回のボルタ電池と合わせて、
覚えることが急激に増えています。
一つ一つ覚えるには、
時間とエネルギーが必要なので、
上記のようにまとめて、
最低限必要なポイントを初めに押さえておきましょう。
では、ダニエル電池のポイントは3つ。
① 電解液は硫酸亜鉛と硫酸銅の2つ!
② 素焼き板で仕切りがある!
③ 銅板に銅が付着する!
ひとまず、一次電池は、
ボルタ電池とダニエル電池の2つを
押さえておくだけでも十分です。
次回は、二次電池と燃料電池を簡単に説明して、
電池分野も一区切りです。
ボルタ電池との違いを区別して、
ダニエル電池、頑張ってみませんか?
【このカテゴリーの最新記事】
-
no image
-
no image
2022年03月09日
ボルタ電池…ボルタって何よ?
こんにちは、YOSHIOです。
今回は電池編の3回目・ボルタ電池です。
ボルタとは、一次電池を発明したイタリアの物理学者。
このボルタさんが発明した一次電池が、ボルタ電池です。
今回は、一次電池の代表であるボルタ電池を使って、
電気の仕組みを簡単にまとめていきます。
電池を扱う上でつかんでおきたいポイントは、
(1)使われている金属と電解液
(2)金属の変化流が流れる向き
(3)電気が流れる向き
の3つです。
では、早速ボルタ電池の登場です!

図をチェックした所で、
早速ポイントを順に確認していきます。
(1)使われている金属と電解液
使われる金属は、亜鉛と銅。
電解液は、うすい硫酸。
使用する素材は決まっているので、
こればかりは、まず初めに覚えるしかありません。
(2)金属の変化
このボルタ電池に電気を流すと…
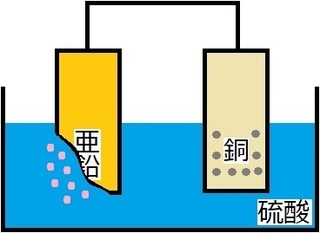
あぁぁ…亜鉛が溶けていく…
という具合に、
亜鉛:溶けていく
銅:溶けずに残る
と変化に違いが現れます。
これは、前回ブログ
「電池に必要な金属を集めるぞ!」
https://fanblogs.jp/studyscience/archive/206/0
で説明しました、
塩酸や硫酸に亜鉛は溶けやすい
という性質にあてはまるからです。
また、銅の方にはポツポツと
くっついている物質が…
これは、気体の水素であることも要チェックです!
(3)電気が流れる向き
電池ということは、電気が流れているはず。
では、ボルタ電池の場合、
電気が流れる向きは…???
溶けずに残る銅から、
溶けてなくなる亜鉛に向かって、
電気は流れます。
つまり、
プラス極:銅 マイナス極:亜鉛
になることを間違えないようにしましょう。
また、補足として、
亜鉛から銅に向かって電子も流れています。
電流と流れる向きは逆であることがポイントです。
難しいことになると、
覚えることが多くなる…
では、ボルタ電池のポイントは4つ。
① 亜鉛は溶ける、銅に水素が発生!
② 電流:+の銅からーの亜鉛へ!
③ 電子:ーの亜鉛から+の銅へ!
④ 電流と電子は流れる向きが逆!
長丁場、お疲れさまでした。
覚えること多い!…ですよね。
まずは、
「亜鉛だけが解けるのか!」
「銅には水素が!」
「電流と電子は向きが逆ね!」
くらいの感覚でも構いません。
ポイントだけはしっかり逃さないように、
ボルタ電池、頑張ってみませんか?
今回は電池編の3回目・ボルタ電池です。
ボルタとは、一次電池を発明したイタリアの物理学者。
このボルタさんが発明した一次電池が、ボルタ電池です。
今回は、一次電池の代表であるボルタ電池を使って、
電気の仕組みを簡単にまとめていきます。
電池を扱う上でつかんでおきたいポイントは、
(1)使われている金属と電解液
(2)金属の変化流が流れる向き
(3)電気が流れる向き
の3つです。
では、早速ボルタ電池の登場です!

図をチェックした所で、
早速ポイントを順に確認していきます。
(1)使われている金属と電解液
使われる金属は、亜鉛と銅。
電解液は、うすい硫酸。
使用する素材は決まっているので、
こればかりは、まず初めに覚えるしかありません。
(2)金属の変化
このボルタ電池に電気を流すと…

あぁぁ…亜鉛が溶けていく…
という具合に、
亜鉛:溶けていく
銅:溶けずに残る
と変化に違いが現れます。
これは、前回ブログ
「電池に必要な金属を集めるぞ!」
https://fanblogs.jp/studyscience/archive/206/0
で説明しました、
塩酸や硫酸に亜鉛は溶けやすい
という性質にあてはまるからです。
また、銅の方にはポツポツと
くっついている物質が…
これは、気体の水素であることも要チェックです!
(3)電気が流れる向き
電池ということは、電気が流れているはず。
では、ボルタ電池の場合、
電気が流れる向きは…???
溶けずに残る銅から、
溶けてなくなる亜鉛に向かって、
電気は流れます。
つまり、
プラス極:銅 マイナス極:亜鉛
になることを間違えないようにしましょう。
また、補足として、
亜鉛から銅に向かって電子も流れています。
電流と流れる向きは逆であることがポイントです。
難しいことになると、
覚えることが多くなる…
では、ボルタ電池のポイントは4つ。
① 亜鉛は溶ける、銅に水素が発生!
② 電流:+の銅からーの亜鉛へ!
③ 電子:ーの亜鉛から+の銅へ!
④ 電流と電子は流れる向きが逆!
長丁場、お疲れさまでした。
覚えること多い!…ですよね。
まずは、
「亜鉛だけが解けるのか!」
「銅には水素が!」
「電流と電子は向きが逆ね!」
くらいの感覚でも構いません。
ポイントだけはしっかり逃さないように、
ボルタ電池、頑張ってみませんか?
2022年03月07日
電池に必要な金属を集めるぞ!
こんにちは、YOSHIOです。
今回は電池編の2回目・電池と金属です。
金属と一言に言っても、
たくさんの種類があります。
金・銀・銅…(オリンピック?)
ナトリウム・マグネシウム・カリウム…(スポドリ?)
鉄・亜鉛・鉛…(…??)
…とりあえず、いっぱい!
ただ、この中から、
今回の電池で使われる金属と性質を
チェックしておく必要があります。
高校化学でも必要な知識になるので、
整理して覚えておくことをおすすめします!
では、早速始めていきますが、
理科の電池で使われやすい金属は、
亜鉛・銅・銀
の3つです。
前回のブログ、
「電池の種類なんて、考えたことないし。」
https://fanblogs.jp/studyscience/archive/205/0
で一次電池・二次電池を扱いましたが、
亜鉛・銅は電池には欠かせない代表的な金属
でもあります。
電池で使う金属の重要ポイントは、
イオンへ変化しやすいかどうか
です。
ちなみに、亜鉛・銅・銀は、
イオンに変化しやすい順番で書いています。
イオンに変化しやすい…??
表現は難しいですが、
もう少し簡単に言いかえると、
塩酸や硫酸などで溶けやすい順番
と考えても良いと思います。
つまり、
亜鉛:よく溶ける
銅:場合によっては溶ける
銀:溶けにくい
ということです。
これらの金属を組み合わせが、
電池に大きなポイントになっています。
そのため、前回ブログの図である

…ヘンテコにも見えますが、
電池の元となっているので、
重要な図でもあったんですね。
では、電池と金属のポイントは3つ。
① 亜鉛・銅・銀は絶対おさえる!
② 亜鉛・銅・銀:イオンになりやすい順番
③ イオンになりやすい=塩酸などに溶けやすい
今回まとめた金属ですが、
高校化学でもベースとなるので、
電池の金属=亜鉛・銅・銀
の順番で覚えておくだけでも、
メリットはかなり大きいです。
次回は電池の元祖といってもいい、
ボルタ電池・ダニエル電池を順番に説明していきます。
今回の金属の重要ポイントを意識して、
電池と金属、頑張ってみませんか?
今回は電池編の2回目・電池と金属です。
金属と一言に言っても、
たくさんの種類があります。
金・銀・銅…(オリンピック?)
ナトリウム・マグネシウム・カリウム…(スポドリ?)
鉄・亜鉛・鉛…(…??)
…とりあえず、いっぱい!
ただ、この中から、
今回の電池で使われる金属と性質を
チェックしておく必要があります。
高校化学でも必要な知識になるので、
整理して覚えておくことをおすすめします!
では、早速始めていきますが、
理科の電池で使われやすい金属は、
亜鉛・銅・銀
の3つです。
前回のブログ、
「電池の種類なんて、考えたことないし。」
https://fanblogs.jp/studyscience/archive/205/0
で一次電池・二次電池を扱いましたが、
亜鉛・銅は電池には欠かせない代表的な金属
でもあります。
電池で使う金属の重要ポイントは、
イオンへ変化しやすいかどうか
です。
ちなみに、亜鉛・銅・銀は、
イオンに変化しやすい順番で書いています。
イオンに変化しやすい…??
表現は難しいですが、
もう少し簡単に言いかえると、
塩酸や硫酸などで溶けやすい順番
と考えても良いと思います。
つまり、
亜鉛:よく溶ける
銅:場合によっては溶ける
銀:溶けにくい
ということです。
これらの金属を組み合わせが、
電池に大きなポイントになっています。
そのため、前回ブログの図である

…ヘンテコにも見えますが、
電池の元となっているので、
重要な図でもあったんですね。
では、電池と金属のポイントは3つ。
① 亜鉛・銅・銀は絶対おさえる!
② 亜鉛・銅・銀:イオンになりやすい順番
③ イオンになりやすい=塩酸などに溶けやすい
今回まとめた金属ですが、
高校化学でもベースとなるので、
電池の金属=亜鉛・銅・銀
の順番で覚えておくだけでも、
メリットはかなり大きいです。
次回は電池の元祖といってもいい、
ボルタ電池・ダニエル電池を順番に説明していきます。
今回の金属の重要ポイントを意識して、
電池と金属、頑張ってみませんか?
2022年03月05日
電池の種類なんて、考えたことないし。
こんにちは、YOSHIOです。
今回から中3理科・イオン分野の電池編で、
その1回目・電池の種類です。
え?この電池のこと?

…電池と言われたら、
正直に、このイメージしか湧きませんよね…。
ところが、今から扱う電池はこんな感じ。

…イヤイヤ、電池じゃないし(笑
とツッコミたいのはやまやまですが、
大目に見てくださるとありがたい…。
さ、さすがに、
乾電池をバラバラに分解できないし…。
※上記の電池の扱いについては、
次回改めてまとめていきます。
ただ、電池と一言に言っても、
どんな種類があるのか、
知っているでしょうか…?
最低限知っておきたい化学分野で扱う電池には、
(1)一次電池
(2)二次電池
(3)燃料電池
があります。
(1)一次電池
一次電池とは、放電のみを行う電池です。
放電とは、電気を流すことです。
例えば、マンガン乾電池・アルカリマンガン乾電池など、
日常的に使う乾電池が当てはまります。
(2)二次電池
二次電池とは、放電と充電の両方を行う電池です。
充電とは、電気を蓄えることです。
例えば、鉛蓄電池・リチウムイオン電池などがあります
この二次電池があるから、
スマホを充電して繰り返し使える!ということ。
(3)燃料電池
燃料電池とは、水素と酸素の化学反応を利用した電池です。
最近注目のエコ電池の一つで、
将来の自動車を動かすエネルギーとして
ニュースで見たことがあります。
実は、これらの電池は、
化学変化を利用していることもあり、
まとめて化学電池と言われています。
では、電池の種類のポイントは4つ。
① 化学電池は化学変化を利用した電池
② 一次電池は放電のみ
③ 二次電池は放電も充電も可能
④ 燃料電池は水素と酸素のエコ電池
今回は電池の種類だけを
大まかにまとめました。
まずは、
「一次電池は放電だけ!」
「二次電池は放電も充電もOK!」
くらいの感覚で大丈夫です。
次回、化学電池のことを詳しく説明します。
言葉と種類分けに注意して、
電池の種類、頑張ってみませんか?
今回から中3理科・イオン分野の電池編で、
その1回目・電池の種類です。
え?この電池のこと?

…電池と言われたら、
正直に、このイメージしか湧きませんよね…。
ところが、今から扱う電池はこんな感じ。

…イヤイヤ、電池じゃないし(笑
とツッコミたいのはやまやまですが、
大目に見てくださるとありがたい…。
さ、さすがに、
乾電池をバラバラに分解できないし…。
※上記の電池の扱いについては、
次回改めてまとめていきます。
ただ、電池と一言に言っても、
どんな種類があるのか、
知っているでしょうか…?
最低限知っておきたい化学分野で扱う電池には、
(1)一次電池
(2)二次電池
(3)燃料電池
があります。
(1)一次電池
一次電池とは、放電のみを行う電池です。
放電とは、電気を流すことです。
例えば、マンガン乾電池・アルカリマンガン乾電池など、
日常的に使う乾電池が当てはまります。
(2)二次電池
二次電池とは、放電と充電の両方を行う電池です。
充電とは、電気を蓄えることです。
例えば、鉛蓄電池・リチウムイオン電池などがあります
この二次電池があるから、
スマホを充電して繰り返し使える!ということ。
(3)燃料電池
燃料電池とは、水素と酸素の化学反応を利用した電池です。
最近注目のエコ電池の一つで、
将来の自動車を動かすエネルギーとして
ニュースで見たことがあります。
実は、これらの電池は、
化学変化を利用していることもあり、
まとめて化学電池と言われています。
では、電池の種類のポイントは4つ。
① 化学電池は化学変化を利用した電池
② 一次電池は放電のみ
③ 二次電池は放電も充電も可能
④ 燃料電池は水素と酸素のエコ電池
今回は電池の種類だけを
大まかにまとめました。
まずは、
「一次電池は放電だけ!」
「二次電池は放電も充電もOK!」
くらいの感覚で大丈夫です。
次回、化学電池のことを詳しく説明します。
言葉と種類分けに注意して、
電池の種類、頑張ってみませんか?
2022年03月03日
電池って言われても、何するの?
こんにちは、YOSHIOです。
いつも当ブログをご利用くださり、
ありがとうございます!!
中3理科・イオン分野もラスト、
電池編に突入です。
…電池?
乾電池のこと?
ザックリ言えば、その通りです。
電池の仕組みに、イオンが使われています。
過去に扱ったイオンをベースに、
中学理科で学習する電池について、
簡単にまとめていきます。
…とは言うものの、
私個人は、
中学理科で電池を学習することに、
あまり気が進まない一人です…。
高校化学でも、
専門的なことを学習しますが、
今までのイオンや中和と違って、
内容が分かりづらいからです。
そのため、
ここだけ押さえておくといいよ!
という部分だけをおさらいできるよう、
簡単にまとめていく予定です。
次回以降の電池編では、
以下の内容を説明していきます。
・電池の種類
・電池の構造
・電池とイオン
図なども扱いながら、
復習につなげられるものをお伝えしていくので、
ノートに書き写しながら、
ポイントを覚えていくようにしてみてくださいね!
イオン分野もラストスパート、
電池編、頑張ってみませんか?
いつも当ブログをご利用くださり、
ありがとうございます!!
中3理科・イオン分野もラスト、
電池編に突入です。
…電池?
乾電池のこと?
ザックリ言えば、その通りです。
電池の仕組みに、イオンが使われています。
過去に扱ったイオンをベースに、
中学理科で学習する電池について、
簡単にまとめていきます。
…とは言うものの、
私個人は、
中学理科で電池を学習することに、
あまり気が進まない一人です…。
高校化学でも、
専門的なことを学習しますが、
今までのイオンや中和と違って、
内容が分かりづらいからです。
そのため、
ここだけ押さえておくといいよ!
という部分だけをおさらいできるよう、
簡単にまとめていく予定です。
次回以降の電池編では、
以下の内容を説明していきます。
・電池の種類
・電池の構造
・電池とイオン
図なども扱いながら、
復習につなげられるものをお伝えしていくので、
ノートに書き写しながら、
ポイントを覚えていくようにしてみてくださいね!
イオン分野もラストスパート、
電池編、頑張ってみませんか?
2022年03月01日
ブレイク:卒業シーズン、受験シーズン。
こんにちは、YOSHIOです。
いつも当ブログをご利用くださり、
ありがとうございます!!
中3理科・中和が一区切りついたので、
ブレイクを挟みます。
ついに3月に突入!
私が住んでいる地域では、
本日が高校の卒業式。
高校3年生の皆さん、
ご卒業おめでとうございます!!
…とは言うものの、
まだこれから受験が控えている高3生は、
気が抜けない状況だと思います。
くれぐれも体調には気を付けて、
最後の最後まで諦めずに、
受験を勝ち抜いてほしいです。
ただ、この1,2年で、
本当に環境が変化しました。
昨日も塾生と話をしていると、
卒業式はオンラインモニターで参加
の予定でしたが…
学年で新型コロナ感染者が出てしまったので、
在校生の出席は中止。
高3生のみの卒業式に前日変更された、
とのこと。
直近に受験を控える人たちにとっては、
流行病だけでなく風邪やインフルエンザにも
気を張らないといけない。
しかも、大人が決めたルールに
従うだけならまだしも、
振り回されてしまうこともある子供たち。
様々なニュースを見てこの1年間、
心苦しい時間が多かったです。
こんな大変な時代に、
「頑張れ!」「負けるな!」
と軽はずみに言えない心境ではありながら、
今まで積み重ねてきた(これからも積み重ねていく)努力が、
少しでも報われてほしい思いでいっぱいです。
いつも当ブログをご利用くださり、
ありがとうございます!!
中3理科・中和が一区切りついたので、
ブレイクを挟みます。
ついに3月に突入!
私が住んでいる地域では、
本日が高校の卒業式。
高校3年生の皆さん、
ご卒業おめでとうございます!!
…とは言うものの、
まだこれから受験が控えている高3生は、
気が抜けない状況だと思います。
くれぐれも体調には気を付けて、
最後の最後まで諦めずに、
受験を勝ち抜いてほしいです。
ただ、この1,2年で、
本当に環境が変化しました。
昨日も塾生と話をしていると、
卒業式はオンラインモニターで参加
の予定でしたが…
学年で新型コロナ感染者が出てしまったので、
在校生の出席は中止。
高3生のみの卒業式に前日変更された、
とのこと。
直近に受験を控える人たちにとっては、
流行病だけでなく風邪やインフルエンザにも
気を張らないといけない。
しかも、大人が決めたルールに
従うだけならまだしも、
振り回されてしまうこともある子供たち。
様々なニュースを見てこの1年間、
心苦しい時間が多かったです。
こんな大変な時代に、
「頑張れ!」「負けるな!」
と軽はずみに言えない心境ではありながら、
今まで積み重ねてきた(これからも積み重ねていく)努力が、
少しでも報われてほしい思いでいっぱいです。
2022年02月27日
中和反応は…水を作ろう!
こんにちは、YOSHIOです。
今回は酸とアルカリの5回目で、中和反応の作り方です。
前回まで扱ってきた中和反応を、
化学反応式で確かめていきます。
…難しそう…
と思うかもしれませんが、
コツをつかめば簡単です!
そして、中3理科の中和反応は、
使う化学式が少ないので、
覚える負担も大きくありません。
まずは、前回までの復習ですが…
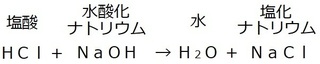
中和は、酸性とアルカリ性の性質を打ち消し合う反応
でした。
そして、中和反応では、必ず水と塩(えん)を生成する
ということを説明しました。
「では、これを化学反応式で作る場合…」
ただでさえ覚えることが多いのに、
授業で説明が始まろうものなら、
「もうイヤァッ!」
と発狂する人も少なくないはず…
ただ、中和の化学反応式は、
水の作り方さえマスターできれば、
スムーズに進みやすいです。
例えば、
塩酸と水酸化ナトリウムの中和で説明すると、
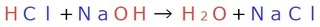
左辺・右辺ともに、赤字に注目してみると、
何か気になった所はありませんか…?
酸性の塩酸のH、
アルカリ性の水酸化ナトリウムのOHで水を、
酸性の塩酸のCl、
アルカリ性の水酸化ナトリウムのNaで塩化ナトリウム
を作っています。
…もっとザックリした言い方をすると…
化学式を作る場合、
酸性の前部+アルカリ性の後部 → 水
酸性の後部+アルカリ性の前部 → 塩
になっています。
「これ…たまたまじゃないの?」
「塩酸と水酸化ナトリウム以外はダメなんじゃ…?」
では、この声に応えるために、
別の例でも試してみましょう。
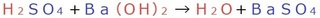
酸性の硫酸H、
アルカリ性の水酸化バリウムのOHで水を、
酸性の硫酸のSO4、
アルカリ性の水酸化バリウムのBaで硫酸バリウム
を作っています。
…ということは、
ここで、中和反応のポイントを3つまとめてみると、
① 中和反応は水を作ることだけを考える
② 化学式:水=酸性の前部+アルカリ性の後部
③ 化学式:塩=酸性の後部+アルカリ性の前部
実は、化学反応式を作る時、
どの原子・分子を結び付けると良いか、
このルールがある程度決まっています。
今回の中和反応の場合は、
酸の前部のあるHとアルカリの後部のOH
これで水を作ることさえできれば、
塩は残り物を結び付けるだけで作れます。
もちろん、化学式を覚えてしまう方法もありますが、
「そんなにたくさん覚えきれない!」
という場合に工夫できる方法かもしれません。
水を作ることに集中して、
中和反応の作り方、頑張ってみませんか?
今回は酸とアルカリの5回目で、中和反応の作り方です。
前回まで扱ってきた中和反応を、
化学反応式で確かめていきます。
…難しそう…
と思うかもしれませんが、
コツをつかめば簡単です!
そして、中3理科の中和反応は、
使う化学式が少ないので、
覚える負担も大きくありません。
まずは、前回までの復習ですが…
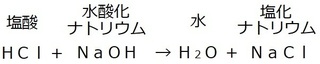
中和は、酸性とアルカリ性の性質を打ち消し合う反応
でした。
そして、中和反応では、必ず水と塩(えん)を生成する
ということを説明しました。
「では、これを化学反応式で作る場合…」
ただでさえ覚えることが多いのに、
授業で説明が始まろうものなら、
「もうイヤァッ!」
と発狂する人も少なくないはず…
ただ、中和の化学反応式は、
水の作り方さえマスターできれば、
スムーズに進みやすいです。
例えば、
塩酸と水酸化ナトリウムの中和で説明すると、
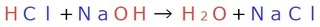
左辺・右辺ともに、赤字に注目してみると、
何か気になった所はありませんか…?
酸性の塩酸のH、
アルカリ性の水酸化ナトリウムのOHで水を、
酸性の塩酸のCl、
アルカリ性の水酸化ナトリウムのNaで塩化ナトリウム
を作っています。
…もっとザックリした言い方をすると…
化学式を作る場合、
酸性の前部+アルカリ性の後部 → 水
酸性の後部+アルカリ性の前部 → 塩
になっています。
「これ…たまたまじゃないの?」
「塩酸と水酸化ナトリウム以外はダメなんじゃ…?」
では、この声に応えるために、
別の例でも試してみましょう。
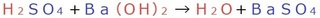
酸性の硫酸H、
アルカリ性の水酸化バリウムのOHで水を、
酸性の硫酸のSO4、
アルカリ性の水酸化バリウムのBaで硫酸バリウム
を作っています。
…ということは、
ここで、中和反応のポイントを3つまとめてみると、
① 中和反応は水を作ることだけを考える
② 化学式:水=酸性の前部+アルカリ性の後部
③ 化学式:塩=酸性の後部+アルカリ性の前部
実は、化学反応式を作る時、
どの原子・分子を結び付けると良いか、
このルールがある程度決まっています。
今回の中和反応の場合は、
酸の前部のあるHとアルカリの後部のOH
これで水を作ることさえできれば、
塩は残り物を結び付けるだけで作れます。
もちろん、化学式を覚えてしまう方法もありますが、
「そんなにたくさん覚えきれない!」
という場合に工夫できる方法かもしれません。
水を作ることに集中して、
中和反応の作り方、頑張ってみませんか?
2022年02月25日
中和は打ち消し合うって、本当!?
こんにちは、YOSHIOです。
今回は酸とアルカリの4回目で、中和反応の本当の意味です。
前回は、
・中和とはどんな反応か?
・中和でどんな物質が生成するか?
を簡単に説明してきました。
今回は、前回説明しきれなかった内容も含めて、
もう少し詳しく説明していきます。
まずは、前回の復習ですが…
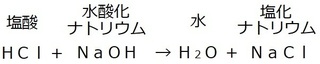
中和は、酸性とアルカリ性を反応させる化学変化
でした。
そして、中和反応では、必ず水と塩(えん)を生成する
ということを説明しました。
…しかし、教科書にある本当の中和の捉え方は、少し違います。
中和とは、
酸性とアルカリ性のお互いの性質を打ち消し合う化学変化
です。
…どういうこと?
さかのぼること…
2021年4月4日のブログ
「電離の分け方は、「前」と「後ろ」の確認!」
https://fanblogs.jp/studyscience/archive/192/0
にヒントがあります。
例えば、

酸性・アルカリ性には、
・酸性物質:物質中に水素イオンを含むこと
・アルカリ性物質:物質中に水酸化物イオンを含むこと
というルールがあります。
※ちなみに、水素イオンと水酸化物イオンの
両方を持つのは「なし」とみなします。
そこで、もう一度上記の中和反応を見てみると、
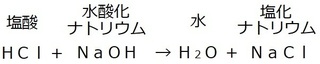
塩酸の水素イオンと、
水酸化ナトリウムの水酸化物イオンが
反応しあってお互いの性質を打ち消す、
という見方をします。
これが、中和である、ということです。
他の例でも確認してみると、

この場合、水素イオンと水酸化物イオンに注目すると、
酸性物質:硫酸
アルカリ性物質:水酸化バリウム
この2つを反応させると、
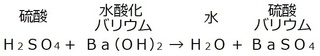
硫酸の水素イオンと、
水酸化バリウムの水酸化物イオンが
反応しあってお互いの性質を打ち消す、
働きをします。
「言葉と式がグチャグチャで訳が分からない!」
難しい説明が続いたので、
分かりづらい部分があったと思います。
ここで、いったんまとめてしまいます。
では、中和反応のポイントは3つ。
① 酸性物質には、水素イオンがある
② アルカリ性物質には、水酸化物イオンがある
③ 中和とは、酸性の水素イオンと
アルカリ性の水酸化物イオンを打ち消し合う反応
この3つだけで十分です。
長く難しい説明だったと思いますが、
最後まで目を通してくださり、
ありがとうございました!
次回、やっと酸とアルカリ:中和が終わります。
今回のことを踏まえて、
中和反応の式を作る
ことに着手していきます。
ポイント整理を怠らないように、
中和の本当の意味、頑張ってみませんか?
今回は酸とアルカリの4回目で、中和反応の本当の意味です。
前回は、
・中和とはどんな反応か?
・中和でどんな物質が生成するか?
を簡単に説明してきました。
今回は、前回説明しきれなかった内容も含めて、
もう少し詳しく説明していきます。
まずは、前回の復習ですが…
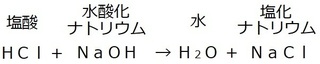
中和は、酸性とアルカリ性を反応させる化学変化
でした。
そして、中和反応では、必ず水と塩(えん)を生成する
ということを説明しました。
…しかし、教科書にある本当の中和の捉え方は、少し違います。
中和とは、
酸性とアルカリ性のお互いの性質を打ち消し合う化学変化
です。
…どういうこと?
さかのぼること…
2021年4月4日のブログ
「電離の分け方は、「前」と「後ろ」の確認!」
https://fanblogs.jp/studyscience/archive/192/0
にヒントがあります。
例えば、

酸性・アルカリ性には、
・酸性物質:物質中に水素イオンを含むこと
・アルカリ性物質:物質中に水酸化物イオンを含むこと
というルールがあります。
※ちなみに、水素イオンと水酸化物イオンの
両方を持つのは「なし」とみなします。
そこで、もう一度上記の中和反応を見てみると、
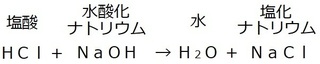
塩酸の水素イオンと、
水酸化ナトリウムの水酸化物イオンが
反応しあってお互いの性質を打ち消す、
という見方をします。
これが、中和である、ということです。
他の例でも確認してみると、

この場合、水素イオンと水酸化物イオンに注目すると、
酸性物質:硫酸
アルカリ性物質:水酸化バリウム
この2つを反応させると、
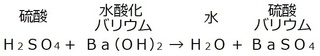
硫酸の水素イオンと、
水酸化バリウムの水酸化物イオンが
反応しあってお互いの性質を打ち消す、
働きをします。
「言葉と式がグチャグチャで訳が分からない!」
難しい説明が続いたので、
分かりづらい部分があったと思います。
ここで、いったんまとめてしまいます。
では、中和反応のポイントは3つ。
① 酸性物質には、水素イオンがある
② アルカリ性物質には、水酸化物イオンがある
③ 中和とは、酸性の水素イオンと
アルカリ性の水酸化物イオンを打ち消し合う反応
この3つだけで十分です。
長く難しい説明だったと思いますが、
最後まで目を通してくださり、
ありがとうございました!
次回、やっと酸とアルカリ:中和が終わります。
今回のことを踏まえて、
中和反応の式を作る
ことに着手していきます。
ポイント整理を怠らないように、
中和の本当の意味、頑張ってみませんか?
2022年02月23日
中和:酸+アルカリ→何が出るかな?
こんにちは、YOSHIOです。
今回は酸とアルカリの3回目で、中和と塩です。
塩…?「しお」のこと…??
「塩」は、「しお」ではなく、「えん」と読みます。
前回まで扱ってきた内容を踏まえて、
酸性とアルカリ性の化学反応
をまとめていきます。
本題に入る前に、前回の確認から。
酸性・アルカリ性で物質を仕分けしました。
今回は、タイトルにもある式に沿って、
酸性物質とアルカリ性物質を反応させますが、
上表の物質を使って2つ作ってみます。
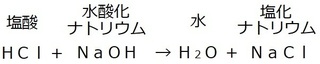
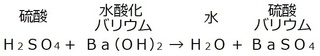
化学反応式を見てみると、
左辺:酸性物質+アルカリ性物質
になっていることをチェックしてくださいね。
では、化学反応の説明を始める前に、
重要な用語を押さえておきましょう。
この化学反応式から分かることですが、
酸性とアルカリ性を反応させる化学変化を、
中和とする、
といいます。
↓
…が、少し補足。
今はこの覚え方で構いません。
これには、深い理由がありまして…
その理由については次回きちんと説明します。
そこで、1つ目の化学反応式を見てみると、
例)塩酸と水酸化ナトリウム水溶液
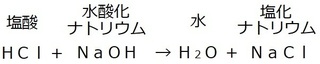
右辺に注目すると、水が生成します。
水の生成は、中和の大きな特徴です。
それと、水以外にもう1つ物質ができます。
今回の場合は、塩化ナトリウム。
中和反応でできた水以外の物質を、
一般的に塩(えん)といいます。
…ということは、
酸性物質とアルカリ性物質を反応させると、
中和が起こり、
水と塩ができる、ということです。
ちなみに、使う物質が違っても仕組みは同じです。
2つ目の例だと、
例)硫酸と水酸化バリウム水溶液
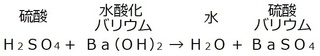
物質が違っても、
酸性物質とアルカリ性物質を反応させると、
中和が起こり、
水と塩ができる、ということに変わりなし!
長くなって読みづらくなりすみません…。
では、中和のポイントは2つ。
① 中和:酸性とアルカリ性を反応させる化学変化
② 中和反応は、必ず水と塩(えん)ができる
…しかし、今回だけで中和の内容は…
伝えきれませんでした。
・中和の本来の意味
・化学反応式の作り方
この2点はとても重要なので、
次回別枠で説明します。
(理由は…扱う内容が多すぎるから)
今回は、
「酸とアルカリで中和になるのか」
「中和は水と塩ができるのね」
これくらいの感覚で大丈夫ですからね。
気負わず一つずつクリアできれば問題ありません。
出てくる言葉を覚えて、
中和と塩、頑張ってみませんか?
今回は酸とアルカリの3回目で、中和と塩です。
塩…?「しお」のこと…??
「塩」は、「しお」ではなく、「えん」と読みます。
前回まで扱ってきた内容を踏まえて、
酸性とアルカリ性の化学反応
をまとめていきます。
本題に入る前に、前回の確認から。
酸性・アルカリ性で物質を仕分けしました。

今回は、タイトルにもある式に沿って、
酸性物質とアルカリ性物質を反応させますが、
上表の物質を使って2つ作ってみます。
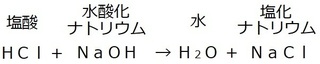
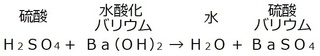
化学反応式を見てみると、
左辺:酸性物質+アルカリ性物質
になっていることをチェックしてくださいね。
では、化学反応の説明を始める前に、
重要な用語を押さえておきましょう。
この化学反応式から分かることですが、
酸性とアルカリ性を反応させる化学変化を、
中和とする、
といいます。
↓
…が、少し補足。
今はこの覚え方で構いません。
これには、深い理由がありまして…
その理由については次回きちんと説明します。
そこで、1つ目の化学反応式を見てみると、
例)塩酸と水酸化ナトリウム水溶液
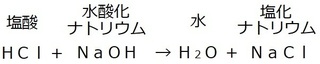
右辺に注目すると、水が生成します。
水の生成は、中和の大きな特徴です。
それと、水以外にもう1つ物質ができます。
今回の場合は、塩化ナトリウム。
中和反応でできた水以外の物質を、
一般的に塩(えん)といいます。
…ということは、
酸性物質とアルカリ性物質を反応させると、
中和が起こり、
水と塩ができる、ということです。
ちなみに、使う物質が違っても仕組みは同じです。
2つ目の例だと、
例)硫酸と水酸化バリウム水溶液
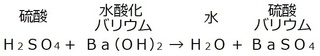
物質が違っても、
酸性物質とアルカリ性物質を反応させると、
中和が起こり、
水と塩ができる、ということに変わりなし!
長くなって読みづらくなりすみません…。
では、中和のポイントは2つ。
① 中和:酸性とアルカリ性を反応させる化学変化
② 中和反応は、必ず水と塩(えん)ができる
…しかし、今回だけで中和の内容は…
伝えきれませんでした。
・中和の本来の意味
・化学反応式の作り方
この2点はとても重要なので、
次回別枠で説明します。
(理由は…扱う内容が多すぎるから)
今回は、
「酸とアルカリで中和になるのか」
「中和は水と塩ができるのね」
これくらいの感覚で大丈夫ですからね。
気負わず一つずつクリアできれば問題ありません。
出てくる言葉を覚えて、
中和と塩、頑張ってみませんか?
2022年02月21日
これって、酸性?それとも、アルカリ性?
こんにちは、YOSHIOです。
今回は酸とアルカリ2回目で、物質の仕分けです。
前回は酸性とアルカリ性の調べ方を扱いました。
しかし、酸性やアルカリ性の物質には
どんなものがあるかを知る必要があります。
…とは言うものの、中3理科ともなれば、
より専門的な物質が出てくるようになります。

…前回あんなに薬品が出てきたのに、
今度は物質名に化学式かよ…。
と、げんなりするのも無理はありません。
そ・こ・で、
物質名と化学式の両方で、
酸性とアルカリ性を仕分けるポイントだけ
押さえていきましょう。
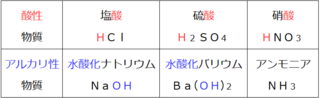
<物質名>
・酸性:語尾に酸が付いている
・アルカリ性:語頭に水酸化が付いている
…少なくとも絶対条件ではありませんが、
中学理科の基本は、この条件で大丈夫です。
(ちなみに、高校理科は少し違ってきますが…)
<化学式>
・酸性:Hから始まる
・アルカリ性:OHで終わる
仕分けの目の付け所を固定することが、
まとめて覚えてしまうコツにもなります。
けれども…
表を見てお気づきの方もいるはず。
アンモニアは…???
アンモニアだけは例外です。
物質名・化学式ともに、
上記のルールが当てはまらないことに注意して、
覚えもれがないようにしましょう。
では、酸性とアルカリ性の仕分けのポイントは3つ。
① 酸性物質:物質名は語尾に酸・化学式はHスタート
② アルカリ性物質:物質名は語頭に水酸化・化学式はOH終わり
③ アンモニアだけは覚えもれがないように
種類に分けて覚えなければならない…
そんな場合は、共通点を見つけて、
覚える負担を少しでも軽くしてあげましょう。
それが、後々別の内容で活きてくることもありますからね。
覚えるポイントに注意しながら、
酸性とアルカリ性の仕分け、頑張ってみませんか?
今回は酸とアルカリ2回目で、物質の仕分けです。
前回は酸性とアルカリ性の調べ方を扱いました。
しかし、酸性やアルカリ性の物質には
どんなものがあるかを知る必要があります。
…とは言うものの、中3理科ともなれば、
より専門的な物質が出てくるようになります。

…前回あんなに薬品が出てきたのに、
今度は物質名に化学式かよ…。
と、げんなりするのも無理はありません。
そ・こ・で、
物質名と化学式の両方で、
酸性とアルカリ性を仕分けるポイントだけ
押さえていきましょう。
<物質名>
・酸性:語尾に酸が付いている
・アルカリ性:語頭に水酸化が付いている
…少なくとも絶対条件ではありませんが、
中学理科の基本は、この条件で大丈夫です。
(ちなみに、高校理科は少し違ってきますが…)
<化学式>
・酸性:Hから始まる
・アルカリ性:OHで終わる
仕分けの目の付け所を固定することが、
まとめて覚えてしまうコツにもなります。
けれども…
表を見てお気づきの方もいるはず。
アンモニアは…???
アンモニアだけは例外です。
物質名・化学式ともに、
上記のルールが当てはまらないことに注意して、
覚えもれがないようにしましょう。
では、酸性とアルカリ性の仕分けのポイントは3つ。
① 酸性物質:物質名は語尾に酸・化学式はHスタート
② アルカリ性物質:物質名は語頭に水酸化・化学式はOH終わり
③ アンモニアだけは覚えもれがないように
種類に分けて覚えなければならない…
そんな場合は、共通点を見つけて、
覚える負担を少しでも軽くしてあげましょう。
それが、後々別の内容で活きてくることもありますからね。
覚えるポイントに注意しながら、
酸性とアルカリ性の仕分け、頑張ってみませんか?