2020年09月29日
溶解度はグラフの移り変わりに要注意!Part.1
こんにちは、YOSHIOです。
今回は物質の7回目、溶解度です。
密度や濃度に続く、化学分野の計算内容です。
しかも、グラフを利用することが多いため、
数値の移り変わりや、
文章問題の内容が分かりにくいなど、
苦手にしている人も多いのではないでしょうか?
そこで、この溶解度に関しては2回にまたいで、
1回目:言葉と表・グラフの見方
2回目:グラフを使った溶解度の計算
という具合に説明していきます。
…そもそも、溶解度とは何でしょうか?
少し変わった決まりがあります。
溶解度とは、水100gに溶かせる溶質の量を指します。
ポイントは、水100gがキーワードで、
私が思い当たる限りでは、
水100gをキーワードにした問題は、
中学理科では溶解度しか思い当たりません。
それくらい、変わりものです。
…ということで、水に溶質をどれだけ溶かせるかを
考えたり計算したりする内容です。
とは言うものの、どんどん水に溶質を加えた所で、
永遠に溶けていく訳はありませんよね。
いつかは、溶けなくなって溶質の粒が残るようになります。
このように、溶質がこれ以上溶けない限界の状態を、
飽和と言います。
また、飽和に達した水溶液のことを、飽和水溶液と言います。
確認すべき基本的な言葉は、この3つです。
ただし、溶解度の難所は、グラフと表を使った計算です。
けれども、今まで教えてきた塾生と話をした時に、
グラフの見方や表の使い方が分からない
という声が圧倒的に多かったです。
では実際に、表やグラフを示したうえで説明していきましょう。
まず表から。
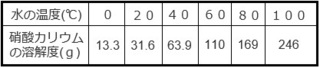
実は、表の見方は1つしかありません。
それは、各温度における水100g当たりの溶解度だけです。
要するに、各温度において
水100gで溶質が最大どれだけ溶けるかを示しているだけです。
例えば、20℃であれば最大31.6g溶ける、
40℃であれば最大63.9g溶ける、ということです。
これさえ分かっていれば、攻略しやすくなります。
続いて、グラフです。
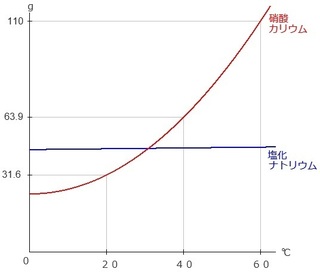
…テンション下がりますね…。
グラフと耳にしただけで身構える人も多いです。
ただ、表と同じようにグラフにもポイントがあります。
では、60℃の水に硝酸カリウム80gを溶かしたとします。
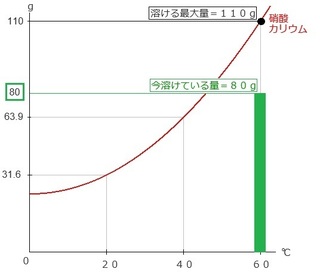
この場合、60℃の縦線とグラフの交点である●から、
水平に横に見ると、「110」に当たります。
硝酸カリウム110gが水温60℃の時の溶解度です。
(言いかえれば、60℃の水100gに溶かせる最大量が110g)
そこに、元々80gしか溶かしていない場合は、
グラフ上に表すと、緑の棒グラフ分しか溶かしていない
ことになります。
問題条件の溶かした量をグラフに書き込むと、
扱いやすくなってきます。
では、もう1つ。
水温を下げた条件が問題で出てきます。
上と同じ条件で、60℃から40℃に水温を下げた場合、
グラフがどうなるかを見ていきます。
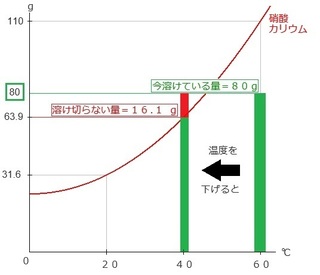
注意点は、水温が変わっても、溶かした量は変わりません!
なので、60℃の緑の棒を、
そのまま40℃の方へスライドさせます。
ただ、赤の棒があるように、
グラフよりも上へはみ出す部分が出てきます。
これは、溶け切らずに出てきた溶質の量です。
この数値を計算させる問題が出題されることがあります。
※ 実際の問題を使った解説はPart.2で扱っていきます。
では、溶解度Part.1のポイントは3つ。
① 溶解度は、水100gに溶かした量
② 飽和は溶かせる溶質の限界量
③ 表・グラフは溶解度(飽和)を表す
言葉は覚えれば済みますが、
表・グラフは使い方が重要です。
すぐに理解しようと焦らなくていいです。
まずは、言葉 → 表 → グラフと
段階的に少しずつクリアしてみてください。
絶対に焦りは禁物です!(中途半端にならないように)
次回はPart.2として、
主にグラフを使用した溶解度の計算を説明していきます。
表やグラフがある中、説明で必要な長文を読んで頂き、
最後までありがとうございました。
2回に渡る長編になりますが、
溶解度、頑張ってみませんか?
≪コメント記入≫
感想や質問など、気軽にコメントしてOKです。
・お名前:ペンネームでOK
・コメント
を記入するだけで構いませんからね。
今回は物質の7回目、溶解度です。
密度や濃度に続く、化学分野の計算内容です。
しかも、グラフを利用することが多いため、
数値の移り変わりや、
文章問題の内容が分かりにくいなど、
苦手にしている人も多いのではないでしょうか?
そこで、この溶解度に関しては2回にまたいで、
1回目:言葉と表・グラフの見方
2回目:グラフを使った溶解度の計算
という具合に説明していきます。
…そもそも、溶解度とは何でしょうか?
少し変わった決まりがあります。
溶解度とは、水100gに溶かせる溶質の量を指します。
ポイントは、水100gがキーワードで、
私が思い当たる限りでは、
水100gをキーワードにした問題は、
中学理科では溶解度しか思い当たりません。
それくらい、変わりものです。
…ということで、水に溶質をどれだけ溶かせるかを
考えたり計算したりする内容です。
とは言うものの、どんどん水に溶質を加えた所で、
永遠に溶けていく訳はありませんよね。
いつかは、溶けなくなって溶質の粒が残るようになります。
このように、溶質がこれ以上溶けない限界の状態を、
飽和と言います。
また、飽和に達した水溶液のことを、飽和水溶液と言います。
確認すべき基本的な言葉は、この3つです。
ただし、溶解度の難所は、グラフと表を使った計算です。
けれども、今まで教えてきた塾生と話をした時に、
グラフの見方や表の使い方が分からない
という声が圧倒的に多かったです。
では実際に、表やグラフを示したうえで説明していきましょう。
まず表から。

実は、表の見方は1つしかありません。
それは、各温度における水100g当たりの溶解度だけです。
要するに、各温度において
水100gで溶質が最大どれだけ溶けるかを示しているだけです。
例えば、20℃であれば最大31.6g溶ける、
40℃であれば最大63.9g溶ける、ということです。
これさえ分かっていれば、攻略しやすくなります。
続いて、グラフです。

…テンション下がりますね…。
グラフと耳にしただけで身構える人も多いです。
ただ、表と同じようにグラフにもポイントがあります。
では、60℃の水に硝酸カリウム80gを溶かしたとします。

この場合、60℃の縦線とグラフの交点である●から、
水平に横に見ると、「110」に当たります。
硝酸カリウム110gが水温60℃の時の溶解度です。
(言いかえれば、60℃の水100gに溶かせる最大量が110g)
そこに、元々80gしか溶かしていない場合は、
グラフ上に表すと、緑の棒グラフ分しか溶かしていない
ことになります。
問題条件の溶かした量をグラフに書き込むと、
扱いやすくなってきます。
では、もう1つ。
水温を下げた条件が問題で出てきます。
上と同じ条件で、60℃から40℃に水温を下げた場合、
グラフがどうなるかを見ていきます。

注意点は、水温が変わっても、溶かした量は変わりません!
なので、60℃の緑の棒を、
そのまま40℃の方へスライドさせます。
ただ、赤の棒があるように、
グラフよりも上へはみ出す部分が出てきます。
これは、溶け切らずに出てきた溶質の量です。
この数値を計算させる問題が出題されることがあります。
※ 実際の問題を使った解説はPart.2で扱っていきます。
では、溶解度Part.1のポイントは3つ。
① 溶解度は、水100gに溶かした量
② 飽和は溶かせる溶質の限界量
③ 表・グラフは溶解度(飽和)を表す
言葉は覚えれば済みますが、
表・グラフは使い方が重要です。
すぐに理解しようと焦らなくていいです。
まずは、言葉 → 表 → グラフと
段階的に少しずつクリアしてみてください。
絶対に焦りは禁物です!(中途半端にならないように)
次回はPart.2として、
主にグラフを使用した溶解度の計算を説明していきます。
表やグラフがある中、説明で必要な長文を読んで頂き、
最後までありがとうございました。
2回に渡る長編になりますが、
溶解度、頑張ってみませんか?
≪コメント記入≫
感想や質問など、気軽にコメントしてOKです。
・お名前:ペンネームでOK
・コメント
を記入するだけで構いませんからね。
【このカテゴリーの最新記事】
-
no image
この記事へのコメント
コメントを書く
この記事へのトラックバックURL
https://fanblogs.jp/tb/10231165
※ブログオーナーが承認したトラックバックのみ表示されます。
この記事へのトラックバック