新規記事の投稿を行うことで、非表示にすることが可能です。
2019年05月09日
ドラッグに翻弄される脳⑧
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳⑧
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
共通の治療法はあるのか
薬物依存症の生物学的基礎の理解が進んだあかつきには、こうした分子レベルの変化をもとに、薬物依存症を生化学的に治療する手がかりがつかめるだろう。
新しい治療法を望む声は強い。
薬物依存は単独でも身体的・心理学的ダメージをもたらすが、それだけではなく、他の様々な疾病を呼び寄せてしまう。
アルコール依存症患者は肝硬変になりやすいし、ヘロイン依存症患者は注射の回し打ちをするのでHIV(エイズ)を蔓延させていく。
米国では、薬物依存によるコスト(治療費や仕事ができなくなることに対する損失など)は年間3000億ドル(2019/5/8 6:45現在1ドル110.244円換算で33兆732億円)以上になると見積もられており、社会が直面する最も深刻な問題の1つとなっている(2019年日本一般会計101兆4564億円)。
依存症の定義を、常軌を逸脱した大食いやギャンブルのような脅迫的で病的な行動にまで広げると、そのコストはもっと高くなる。
コカインやチーズケーキ、ブラックジャックで勝つスリルなどの報酬刺激に対する依存行動を矯正できる治療法があるなら、それは社会に大きな利益をもたらすものになるだろう。
しかし今日の治療法では、ほとんどの依存症は治すことが極めて難しい。
薬物が標的にたどり着くのを防ぐ治療薬はあるが、患者の「依存脳」はそのままになっているから、薬物への強い欲求は残っており、これが問題になるのだ。
常習性薬物と似た作用を示す別の薬を与えて渇望感を抑え、最終的に依存から脱却させるという方法もあるが、これでは依存の対象が代用薬に置き換わっているに過ぎないと言える。
また、患者たちの自助グループで行われている有名な「12ステップ法」のように、薬などを用いない回復プログラムもあり、患者が手探りで依存症を克服するのを助けているが、それでも再発の割合は高い(12ステップ法は「自分は薬物(酒、ギャンブルなど)への欲求に対して無力であり、そのために人生が行き詰ってしまった」と認めることから始め、それまでにしてきたことや迷惑をかけた人のリストを作るなどして、自分を見つめ直すことで、依存症からの回復を図る)。
依存症のメカニズムが生物学的に分かりつつあるので、将来はきっと優れた治療法が見つかるだろう。
脳の報酬回路に対する薬物の長期的効果を抑えたり補ったりするような治療薬をデザインできるだろう。
側坐核のグルタミン酸受容体やドーパミン受容体に特異的に結合する薬剤や、CREBやΔFosBが標的遺伝子に作用しないようにする薬剤を作れば、薬物への依存性を弱められるだろう。
さらに、薬物依存症に陥りやすい人がいるということを認識しなくてはならない。
依存症は心理学的、社会的、環境的因子による部分が大きいとわかっているが、もともと薬物に対する感受性の高い家族の研究によれば、薬物依存のリスクの50%は遺伝的なものらしい。
具体的な遺伝子はまだ見つかっていないが、リスクの高い人を早くに見分けることができれば、その人たちに的を絞った対策が立てられる。
依存には感情的、社会的因子も関与するので、完全に治す薬剤ができるとは限らない。
しかし将来的には、常習を引き起こす強力な要因である依存や渇望感を減らす治療法が実現すると信じたい。
そして、それによって社会心理学的な治療がより効果的になると期待できる。
著者 E. J. Nestler/R. C. Malenka
2人は精神科医としての教育を受け、薬物依存の生物学的基礎を学んだ。
ネスラーはテキサス大学ダラス校サウスウエスタン医学センターの精神科教授で、M.D.とPh.D.を取得後、10年間カリフォルニア大学サンフランシスコ校で過ごし、1999年にスタンフォード大学医学部の一員になった。
カリフォルニア大学では薬物依存神経生物学センターの所長を務めた。
ネスラーとマレンカは、現ハーバード大がくのハイマン(Steven E. Hyman)とともに教科書『Molecular Basis of Neuro-pharmacology(McGraw-Hill, 2001)』を出版した。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳⑧
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
共通の治療法はあるのか
薬物依存症の生物学的基礎の理解が進んだあかつきには、こうした分子レベルの変化をもとに、薬物依存症を生化学的に治療する手がかりがつかめるだろう。
新しい治療法を望む声は強い。
薬物依存は単独でも身体的・心理学的ダメージをもたらすが、それだけではなく、他の様々な疾病を呼び寄せてしまう。
アルコール依存症患者は肝硬変になりやすいし、ヘロイン依存症患者は注射の回し打ちをするのでHIV(エイズ)を蔓延させていく。
米国では、薬物依存によるコスト(治療費や仕事ができなくなることに対する損失など)は年間3000億ドル(2019/5/8 6:45現在1ドル110.244円換算で33兆732億円)以上になると見積もられており、社会が直面する最も深刻な問題の1つとなっている(2019年日本一般会計101兆4564億円)。
依存症の定義を、常軌を逸脱した大食いやギャンブルのような脅迫的で病的な行動にまで広げると、そのコストはもっと高くなる。
コカインやチーズケーキ、ブラックジャックで勝つスリルなどの報酬刺激に対する依存行動を矯正できる治療法があるなら、それは社会に大きな利益をもたらすものになるだろう。
しかし今日の治療法では、ほとんどの依存症は治すことが極めて難しい。
薬物が標的にたどり着くのを防ぐ治療薬はあるが、患者の「依存脳」はそのままになっているから、薬物への強い欲求は残っており、これが問題になるのだ。
常習性薬物と似た作用を示す別の薬を与えて渇望感を抑え、最終的に依存から脱却させるという方法もあるが、これでは依存の対象が代用薬に置き換わっているに過ぎないと言える。
また、患者たちの自助グループで行われている有名な「12ステップ法」のように、薬などを用いない回復プログラムもあり、患者が手探りで依存症を克服するのを助けているが、それでも再発の割合は高い(12ステップ法は「自分は薬物(酒、ギャンブルなど)への欲求に対して無力であり、そのために人生が行き詰ってしまった」と認めることから始め、それまでにしてきたことや迷惑をかけた人のリストを作るなどして、自分を見つめ直すことで、依存症からの回復を図る)。
依存症のメカニズムが生物学的に分かりつつあるので、将来はきっと優れた治療法が見つかるだろう。
脳の報酬回路に対する薬物の長期的効果を抑えたり補ったりするような治療薬をデザインできるだろう。
側坐核のグルタミン酸受容体やドーパミン受容体に特異的に結合する薬剤や、CREBやΔFosBが標的遺伝子に作用しないようにする薬剤を作れば、薬物への依存性を弱められるだろう。
さらに、薬物依存症に陥りやすい人がいるということを認識しなくてはならない。
依存症は心理学的、社会的、環境的因子による部分が大きいとわかっているが、もともと薬物に対する感受性の高い家族の研究によれば、薬物依存のリスクの50%は遺伝的なものらしい。
具体的な遺伝子はまだ見つかっていないが、リスクの高い人を早くに見分けることができれば、その人たちに的を絞った対策が立てられる。
依存には感情的、社会的因子も関与するので、完全に治す薬剤ができるとは限らない。
しかし将来的には、常習を引き起こす強力な要因である依存や渇望感を減らす治療法が実現すると信じたい。
そして、それによって社会心理学的な治療がより効果的になると期待できる。
著者 E. J. Nestler/R. C. Malenka
2人は精神科医としての教育を受け、薬物依存の生物学的基礎を学んだ。
ネスラーはテキサス大学ダラス校サウスウエスタン医学センターの精神科教授で、M.D.とPh.D.を取得後、10年間カリフォルニア大学サンフランシスコ校で過ごし、1999年にスタンフォード大学医学部の一員になった。
カリフォルニア大学では薬物依存神経生物学センターの所長を務めた。
ネスラーとマレンカは、現ハーバード大がくのハイマン(Steven E. Hyman)とともに教科書『Molecular Basis of Neuro-pharmacology(McGraw-Hill, 2001)』を出版した。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月08日
ドラッグに翻弄される脳⑦
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳⑦
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
報酬系以外にも
ここまで、薬物が脳の報酬系に引き起こすドーパミン関連の変化に焦点を当ててきた。
しかし、脳の他の領域も思い出していただこう。
扁桃や海馬、前頭葉なども依存症に関係しており、これらがVTA(腹側被蓋野)や側坐核と互いに交信しているのだ。
これらすべての領域が、神経伝達物質グルタミン酸を放出して報酬回路と信号をやりとりしている。
乱用薬物がVTAから側坐核へのドーパミン放出を促進している時、同時にVTAや側坐核のグルタミン酸に対する応答性も数日の間に変化している。
動物実験によると、報酬回路のグルタミン酸に対する感受性が変化し、それがVTAからのドーパミン放出を促すと同時に、側坐核のドーパミン応答性を高めている。
それによってCREB(サイクリックAMP応答配列結合タンパク質)やΔ(デルタ)FosBの活性が高まり、これらの分子の持つ不幸な効果が現れるようになるのだ。
その上、グルタミン酸感受性が変わることによって、薬物摂取経験に関連した記憶が強まり、もっと薬物を探したいという欲求が高まる結果となる。
薬物が報酬回路のグルタミン酸感受性を変えるメカニズムについては、まだはっきりわかってはいないが、作業仮説が立てられている。
グルタミン酸が海馬のニューロンにどう作用するかという知識をもとにした仮説だ。
短期間の刺激が、グルタミン酸に対する細胞の反応性を何時間にもわたって増強するのだ。
この現象は長期増強と呼ばれ、記憶の形成を助けている。
その仕組みは、特定のグルタミン酸受容体タンパク質が、細胞内の貯蔵場所と細胞膜上を往復することにあるらしい。
細胞内にある時は非活性だが、膜上に出ると、シナプス間隙にあるグルタミン酸と結合して、一連の反応を引き起こす活性型となる。
乱用薬物は、報酬回路の受容体タンパク質の往復に影響を与えるのだ。
ある報告によれば、薬物は特定のグルタミン酸受容体の合成にも影響を与えるらしい。
これらを考え合わせると、ここまで述べてきた報酬回路に見られる変化は全て最終的に、耐性・依存・渇望感・再発、さらに依存症に認められる複雑な行動を促している。
多くの点が未解決だが、はっきり言えることもある。
薬物使用が長く続く間、そして使用が終わった直後には、報酬回路のニューロンの中でcAMP(サイクリックAMP)の濃度とCREBの活性変化が顕著になる。
これらの変化によって耐性と依存が生じ、薬剤感受性が低下し、依存症患者はうつ状態になって何もする気が無くなる。
薬物摂取を長い間ずっと止めると、ΔFosB活性とグルタミン酸シグナルの変化が主役になる。
これらは、患者を再び依存に引き戻すように働く。
薬物に対する感受性を高めるほか、昔のハイな気分の記憶とその記憶を思い出させるような事物に患者が強く反応するようになるためだ。
CREBやΔFosBの濃度とグルタミン酸シグナルの変化は、薬物依存をもたらす主な要因だが、これが全てではない。
研究が進めば、報酬回路や関連する脳領域で働いているその他の重要な分子や細胞適応が明らかになり、依存症の本質が見えてくるだろう。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳⑦
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
報酬系以外にも
ここまで、薬物が脳の報酬系に引き起こすドーパミン関連の変化に焦点を当ててきた。
しかし、脳の他の領域も思い出していただこう。
扁桃や海馬、前頭葉なども依存症に関係しており、これらがVTA(腹側被蓋野)や側坐核と互いに交信しているのだ。
これらすべての領域が、神経伝達物質グルタミン酸を放出して報酬回路と信号をやりとりしている。
乱用薬物がVTAから側坐核へのドーパミン放出を促進している時、同時にVTAや側坐核のグルタミン酸に対する応答性も数日の間に変化している。
動物実験によると、報酬回路のグルタミン酸に対する感受性が変化し、それがVTAからのドーパミン放出を促すと同時に、側坐核のドーパミン応答性を高めている。
それによってCREB(サイクリックAMP応答配列結合タンパク質)やΔ(デルタ)FosBの活性が高まり、これらの分子の持つ不幸な効果が現れるようになるのだ。
その上、グルタミン酸感受性が変わることによって、薬物摂取経験に関連した記憶が強まり、もっと薬物を探したいという欲求が高まる結果となる。
薬物が報酬回路のグルタミン酸感受性を変えるメカニズムについては、まだはっきりわかってはいないが、作業仮説が立てられている。
グルタミン酸が海馬のニューロンにどう作用するかという知識をもとにした仮説だ。
短期間の刺激が、グルタミン酸に対する細胞の反応性を何時間にもわたって増強するのだ。
この現象は長期増強と呼ばれ、記憶の形成を助けている。
その仕組みは、特定のグルタミン酸受容体タンパク質が、細胞内の貯蔵場所と細胞膜上を往復することにあるらしい。
細胞内にある時は非活性だが、膜上に出ると、シナプス間隙にあるグルタミン酸と結合して、一連の反応を引き起こす活性型となる。
乱用薬物は、報酬回路の受容体タンパク質の往復に影響を与えるのだ。
ある報告によれば、薬物は特定のグルタミン酸受容体の合成にも影響を与えるらしい。
これらを考え合わせると、ここまで述べてきた報酬回路に見られる変化は全て最終的に、耐性・依存・渇望感・再発、さらに依存症に認められる複雑な行動を促している。
多くの点が未解決だが、はっきり言えることもある。
薬物使用が長く続く間、そして使用が終わった直後には、報酬回路のニューロンの中でcAMP(サイクリックAMP)の濃度とCREBの活性変化が顕著になる。
これらの変化によって耐性と依存が生じ、薬剤感受性が低下し、依存症患者はうつ状態になって何もする気が無くなる。
薬物摂取を長い間ずっと止めると、ΔFosB活性とグルタミン酸シグナルの変化が主役になる。
これらは、患者を再び依存に引き戻すように働く。
薬物に対する感受性を高めるほか、昔のハイな気分の記憶とその記憶を思い出させるような事物に患者が強く反応するようになるためだ。
CREBやΔFosBの濃度とグルタミン酸シグナルの変化は、薬物依存をもたらす主な要因だが、これが全てではない。
研究が進めば、報酬回路や関連する脳領域で働いているその他の重要な分子や細胞適応が明らかになり、依存症の本質が見えてくるだろう。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月07日
ドラッグに翻弄される脳⑥
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳⑥
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
なぜ再発しやすくなるのか
依存をもたらすメカニズムの中で、デルタFosB(ΔFosB)はCREB(サイクリックAMP応答配列結合タンパク質)とは全く異なる働きをしているようだ。
マウスやラットを使った研究によれば、薬物を慢性的に乱用すると側坐核などでΔFosB濃度が徐々に上昇していく。
その上、ΔFosBは転写因子としては例外的に安定なタンパク質なので、薬物を摂取してから何週間も何ヶ月もニューロン内での活性化した状態が続く。
この持続性のせいで、薬物摂取を止めた後も遺伝子発現パターンはずっと変化したままの状態となる。
側坐核でΔFosBが過剰にできるようにした遺伝子組み換えマウスでの研究から、ΔFosBが長期間作られていると薬物に対して超過敏になることがわかっている。
これらのマウスを一旦薬物から遠ざけ、後になってまた摂取可能にすると、再発しやすかったのだ。
これは、ΔFosBがヒトでも報酬回路の感受性を長期的に増加させている可能性があることを示す発見だった。
興味深いことにマウスでは、常軌を超えて回し車を回す”回し車依存症”や、砂糖を採り続ける”甘いもの依存症”のような非薬物系の反復報酬に対しても、ΔFosBが側坐核で合成される。
ΔFosBは広範な報酬刺激に対する脅迫的行動の発達に、より一般的に関与しているらしい。
最近の研究結果から、ΔFosBが正常レベルに戻った後でも感受性が持続するメカニズムについてヒントが得られた。
コカインなどの乱用薬物に慢性的に曝露される、シグナルを受け取る側坐核の樹状突起に棘(スパイン)と呼ばれる芽のようなものが生じ、そこで他のニューロンと連結するようになる。
ネズミでは、薬物摂取を止めても新しい棘が数ヶ月にわたってでき続ける。
これらの発見は、ΔFosBが余分な棘の生成に関わることを示唆している。
これらの結果から以下のようなことが推測できる。
まず、ΔFosBが活性化すると、ニューロンを結ぶ結合の数が増え、信号伝達が強化された状態が何年にもわたって続く。
そこに薬物に関連した情報が入ってくると、脳が過剰な反応を示すのではないだろうか。
依存症からの脱却が難しいのは、樹状突起がこのように変化してしまうためだろう。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳⑥
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
なぜ再発しやすくなるのか
依存をもたらすメカニズムの中で、デルタFosB(ΔFosB)はCREB(サイクリックAMP応答配列結合タンパク質)とは全く異なる働きをしているようだ。
マウスやラットを使った研究によれば、薬物を慢性的に乱用すると側坐核などでΔFosB濃度が徐々に上昇していく。
その上、ΔFosBは転写因子としては例外的に安定なタンパク質なので、薬物を摂取してから何週間も何ヶ月もニューロン内での活性化した状態が続く。
この持続性のせいで、薬物摂取を止めた後も遺伝子発現パターンはずっと変化したままの状態となる。
側坐核でΔFosBが過剰にできるようにした遺伝子組み換えマウスでの研究から、ΔFosBが長期間作られていると薬物に対して超過敏になることがわかっている。
これらのマウスを一旦薬物から遠ざけ、後になってまた摂取可能にすると、再発しやすかったのだ。
これは、ΔFosBがヒトでも報酬回路の感受性を長期的に増加させている可能性があることを示す発見だった。
興味深いことにマウスでは、常軌を超えて回し車を回す”回し車依存症”や、砂糖を採り続ける”甘いもの依存症”のような非薬物系の反復報酬に対しても、ΔFosBが側坐核で合成される。
ΔFosBは広範な報酬刺激に対する脅迫的行動の発達に、より一般的に関与しているらしい。
最近の研究結果から、ΔFosBが正常レベルに戻った後でも感受性が持続するメカニズムについてヒントが得られた。
コカインなどの乱用薬物に慢性的に曝露される、シグナルを受け取る側坐核の樹状突起に棘(スパイン)と呼ばれる芽のようなものが生じ、そこで他のニューロンと連結するようになる。
ネズミでは、薬物摂取を止めても新しい棘が数ヶ月にわたってでき続ける。
これらの発見は、ΔFosBが余分な棘の生成に関わることを示唆している。
これらの結果から以下のようなことが推測できる。
まず、ΔFosBが活性化すると、ニューロンを結ぶ結合の数が増え、信号伝達が強化された状態が何年にもわたって続く。
そこに薬物に関連した情報が入ってくると、脳が過剰な反応を示すのではないだろうか。
依存症からの脱却が難しいのは、樹状突起がこのように変化してしまうためだろう。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月06日
ドラッグに翻弄される脳⑤
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳⑤
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
常習行動が生まれる
常習の初期段階では、耐性と依存が生じる。
耐性とは、繰り返し摂取するうちに薬物の効きが悪くなることをいう。
遊び半分で薬物を摂取しているうちに、いつもと同じ気分や集中力を得るために、薬物を多めに必要とするようになる。
この耐性が薬物使用をエスカレートさせ、それが依存を生み出していく。
依存は苦痛を伴う感情的反応で、薬物摂取を止められると身体的反応を引き起こすともある。
耐性も依存も、何度も薬物を使用した結果、脳の報酬回路の各部分が、皮肉にも抑制されることによって起こる。
この残酷な抑制の中心となっているのはCREB(サイクリックAMP応答配列結合タンパク質)という物質だ。
CREBは遺伝子のオン・オフを制御しているタンパク質で、遺伝子のオン・オフを通じてニューロンの働きを総合的にコントロールしている。
常習性のある薬物を摂取していると側坐核のドーパミン濃度が上昇し、サイクリックAMP(cAMP)という小さな分子が合成され始める。
これがCREBを活性化する。
活性化したCREBは一群の遺伝子に結合し、それらの遺伝子からタンパク質が作られ始める。
繰り返し薬物を使用するとCREBの活性が持続し、標的遺伝子からはどんどんタンパク質が作られる。
そのうちのいくつかが報酬回路を鈍らせる。
その1つが、アヘンに似た作用をする生体分子のダイノルフィンだ。ダイノルフィンは側坐核のニューロンの一部で合成され、VTA(腹側被蓋野)のニューロンの働きを抑える。
CREBによってダイノルフィンが作られると、脳の報酬回路が抑圧され、同じ量の薬物で得られる快感が少なくなる。
こうして耐性が出来上がる。
ダイノルフィンの増加は、依存も生む。
報酬回路が阻害されてしまうので、薬物が欠乏すると以前は楽しいと思っていた行為を楽しめなくなり、うつ状態に陥ってしまうからだ。
しかし、CREBだけでは全てを説明することはできない。
この転写因子は、薬物使用を止めると数日でスイッチがオフになるからだ。
何年も何十年も中断の後でさえ、薬物常習位戻ってしまうのは説明できない。
そうした再発が起きるのは、薬物に対しる感受性の高まりによるところが多い。
薬物の効果が強く感じられるようになるのだ。
意外に思えるかもしれないが、同じ薬物が耐性と感受性の高まりの両方を引き出す。
薬物を摂取するとすぐにCREB濃度が高くなり、耐性が出現する。
数日の間、薬物使用者は報酬回路を刺激しようと摂取量を増やすことになるだろう。
しかし、薬を断てばCREB活性は低下する。
この時点で耐性は終わりに近づき、感受性が高くなってくる。
感受性が高まると、薬を求める強い渇望感が生じる。
常習者は薬物が切れ始めると強い渇望感を感じて脅迫的な薬物探索行動を繰り返す。
薬物をほんのひと舐めしたり、摂取した記憶を呼び起こしただけでも、依存症に戻るきっかけとなる。
この容赦のない渇望感は、薬物を長期間にわたって断った後でもなかなか消えない。
何がどうやって感受性を高めているのかを知るには、数日間は元に戻らない分子的な変化を探す必要がある。
そうした候補の1つが転写因子のデルタFosB(ΔFosB)だ。
画像診断で見えてくること
コカイン依存患者の脳を画像診断装置で見ると、動物実験での結果と同じことが起きているとわかる。
薬物を摂取すると脳のいろいろな領域での活性が即座に変化する。
スキャンの間、被験者には薬物摂取後の爽快感と渇望感を0~3点で点数化してもらった。
VTAと副レンズ伸長扁桃核がコカインによる急激な爽快感に重要であり、その後に訪れる渇望感には扁桃と側坐核が影響を与えていることが明らかになった。
依存性のない薬物を与えられた動物の側坐核にあるニューロンを顕微鏡で見ると、樹状突起にある棘(スパイン)という突出物の数は正常だ。
棘はシグナルを受け取る機能がある。
コカイン依存症の動物では余分な棘が生まれ、たくさんあるように見える。
おそらく、このように過剰に棘があることが、VTAなどからのシグナルにより敏感になり、薬物に対する感受性が変わる原因となっているのだろう。
最近の研究によるとデルタFosBが棘の成長に一段買っているらしい。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳⑤
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
常習行動が生まれる

常習の初期段階では、耐性と依存が生じる。
耐性とは、繰り返し摂取するうちに薬物の効きが悪くなることをいう。
遊び半分で薬物を摂取しているうちに、いつもと同じ気分や集中力を得るために、薬物を多めに必要とするようになる。
この耐性が薬物使用をエスカレートさせ、それが依存を生み出していく。
依存は苦痛を伴う感情的反応で、薬物摂取を止められると身体的反応を引き起こすともある。
耐性も依存も、何度も薬物を使用した結果、脳の報酬回路の各部分が、皮肉にも抑制されることによって起こる。
この残酷な抑制の中心となっているのはCREB(サイクリックAMP応答配列結合タンパク質)という物質だ。
CREBは遺伝子のオン・オフを制御しているタンパク質で、遺伝子のオン・オフを通じてニューロンの働きを総合的にコントロールしている。
常習性のある薬物を摂取していると側坐核のドーパミン濃度が上昇し、サイクリックAMP(cAMP)という小さな分子が合成され始める。
これがCREBを活性化する。
活性化したCREBは一群の遺伝子に結合し、それらの遺伝子からタンパク質が作られ始める。
繰り返し薬物を使用するとCREBの活性が持続し、標的遺伝子からはどんどんタンパク質が作られる。
そのうちのいくつかが報酬回路を鈍らせる。
その1つが、アヘンに似た作用をする生体分子のダイノルフィンだ。ダイノルフィンは側坐核のニューロンの一部で合成され、VTA(腹側被蓋野)のニューロンの働きを抑える。
CREBによってダイノルフィンが作られると、脳の報酬回路が抑圧され、同じ量の薬物で得られる快感が少なくなる。
こうして耐性が出来上がる。
ダイノルフィンの増加は、依存も生む。
報酬回路が阻害されてしまうので、薬物が欠乏すると以前は楽しいと思っていた行為を楽しめなくなり、うつ状態に陥ってしまうからだ。
しかし、CREBだけでは全てを説明することはできない。
この転写因子は、薬物使用を止めると数日でスイッチがオフになるからだ。
何年も何十年も中断の後でさえ、薬物常習位戻ってしまうのは説明できない。
そうした再発が起きるのは、薬物に対しる感受性の高まりによるところが多い。
薬物の効果が強く感じられるようになるのだ。
意外に思えるかもしれないが、同じ薬物が耐性と感受性の高まりの両方を引き出す。
薬物を摂取するとすぐにCREB濃度が高くなり、耐性が出現する。
数日の間、薬物使用者は報酬回路を刺激しようと摂取量を増やすことになるだろう。
しかし、薬を断てばCREB活性は低下する。
この時点で耐性は終わりに近づき、感受性が高くなってくる。
感受性が高まると、薬を求める強い渇望感が生じる。
常習者は薬物が切れ始めると強い渇望感を感じて脅迫的な薬物探索行動を繰り返す。
薬物をほんのひと舐めしたり、摂取した記憶を呼び起こしただけでも、依存症に戻るきっかけとなる。
この容赦のない渇望感は、薬物を長期間にわたって断った後でもなかなか消えない。
何がどうやって感受性を高めているのかを知るには、数日間は元に戻らない分子的な変化を探す必要がある。
そうした候補の1つが転写因子のデルタFosB(ΔFosB)だ。
画像診断で見えてくること
コカイン依存患者の脳を画像診断装置で見ると、動物実験での結果と同じことが起きているとわかる。
薬物を摂取すると脳のいろいろな領域での活性が即座に変化する。
スキャンの間、被験者には薬物摂取後の爽快感と渇望感を0~3点で点数化してもらった。
VTAと副レンズ伸長扁桃核がコカインによる急激な爽快感に重要であり、その後に訪れる渇望感には扁桃と側坐核が影響を与えていることが明らかになった。
依存性のない薬物を与えられた動物の側坐核にあるニューロンを顕微鏡で見ると、樹状突起にある棘(スパイン)という突出物の数は正常だ。
棘はシグナルを受け取る機能がある。
コカイン依存症の動物では余分な棘が生まれ、たくさんあるように見える。
おそらく、このように過剰に棘があることが、VTAなどからのシグナルにより敏感になり、薬物に対する感受性が変わる原因となっているのだろう。
最近の研究によるとデルタFosBが棘の成長に一段買っているらしい。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月05日
ドラッグに翻弄される脳④
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳④
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
ドーパミンの大洪水
依存性の薬物は化学構造の上で共通した特徴はなく、身体に及ぼす効果も様々だ。
それなのに、なぜ脳の報酬回路に全く同じ効果をもたらすのだろうか?
心臓を疾駆させる興奮剤のコカインと苦痛を抑える鎮静剤のヘロインは全く逆の方向に作用するのに、どうして報酬系には同じように働くのだろう。
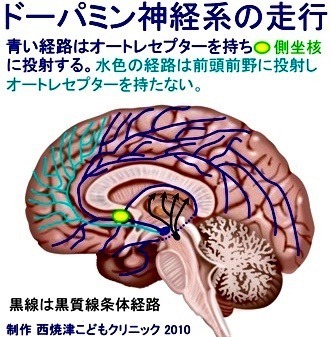
その答えは、どの乱用薬物の場合も、側坐核にドーパミンやそれに似たシグナルが大量に流れ込むようになるからだ。
VTA(腹側被蓋野)のニューロンが興奮すると、電気的な信号が軸索を流れる。
軸索は側坐核へと繋がるハイウェイのようなものだ。
この電気シグナルが軸索の末端にあるシナプスに届くと、そこからドーパミンが放出される。
シナプスは、狭い空間(シナプス間隙)に放出されたドーパミンは側坐核のニューロン上にある受容体にとらえられ、細胞内に情報を伝える。
同時に、放出した側のVTAニューロンが再利用のためにドーパミンを回収する。
こうしてシナプス間隙からドーパミンが停止する。
コカインを始めとする興奮剤は、VTAニューロンがドーパミンを回収するときに使うトランスポーター分子(輸送体)を一時的に阻害する。
そのために過剰なドーパミンが側坐核に働いてしまう。
一方、ヘロインなどのオピエート(アヘン類、オピオイド)は、VTA内にあるドーパミン放出ニューロンとは別のニューロンに結合する。
このニューロンは本来はドーパミン放出ニューロンの機能を抑える働きをするが、オピエートはこの締め付けを解いてしまう。
このため、やはり余分なドーパミンが側坐核に流れ込んでしまう。
またオピエートは、側坐核に直接働いて強い「報酬」信号を発生させる。
しかし薬物はドーパミンの過剰放出を引き起こして快感をもたらしたり、最初の報酬シグナルを仲介したり強化するだけではない。
なんども薬物にさらされると、報酬回路の方が、次第に薬物のある状態に慣れて順応してしまう。
これが依存を生じさせる。
薬物で脳のどこが影響を受けるか
薬物を慢性的に使うと、報酬回路の一番重要な部分で活動や構造が変化する。
その部分とはVTA(腹側被蓋野)のドーパミンを作るニューロンから側坐核のドーパミンを受ける細胞への経路だ。
この変化は、下記の分子反応によって誘導される。
CREB(記憶に必要なたの遺伝子を調節し、長期記憶形成に必要なタンパク質):耐性の原因
VTAにあるドーパミンを放出ニューロンが興奮すると、ドーパミンが神経末端から放出され、側坐核のシナプス受容体にはまる(ドーパミンシグナル)と、細胞内にcAMP(サイクリックAMP、細胞内情報伝達物質)とCaイオン濃度が上昇し、CREBが即座に活性化される。
CREBは、DNAに結合して特定の遺伝子群を活性化し、記憶形成に関わるタンパク質を合成する。
例えばダイノルフィンというタンパク質がVTAに向けて放出されると、VTAではドーパミンの放出が抑えられ、報酬回路も抑制される。
こうなると、依存症の患者はハイな気分になろうとしてもっと薬物を求めるようになる。
ΔFosB(デルタFosB):渇望感の原因
ドーパミンシグナルがΔFosBタンパク質の合成を引き起こす。
ΔFosBはダイノルフィンの合成を抑制し、特定の遺伝子群を活性化する(CREBによって活性化されるものとは別の遺伝子群)。
活性化された遺伝子群は、薬物や薬物関連の事物に対する敏感さに関わるタンパク質を作る。
例えばCDK5というタンパク質は、側坐核の神経を持続的に薬物過敏にしたり、薬物関連の手がかりに対して過敏になるような構造変化を促進させる。
効かない・効きすぎるーその差を決めるタイミング
薬物の効きが悪くなる(耐性)か、
逆に過敏になる(感受性が高くなる)かは、
側坐核のニューロン内にある活性型CREBとΔFosBの濃度が関係しているようだ。
最初はCREBの濃度が高く、耐性が生じて、以前の使用量ではハイな気分を味わえなくなる。
薬物が体内からなくなると不快感が現れ、これをなくすにはもっと多くの薬物が必要となる。
しかしCREBの活性は、繰り返し摂取しない限り、数日間で落ちていく。
これとは反対に、ΔFosB濃度は一度上昇すると、最後の薬物摂取から数週間経っても高いまま維持される。
CREB活性が低下してくると、ΔFosBの持つ危険な長期的感受性の高まりが主流になる。
この一連の反応が、耐性や依存、薬物を求める強い渇望感を引き起こす。
一旦変化が起きると長期間、薬物を辞めていても再発しやすい。
これにも、この反応が関与している。
側坐核とVTAが、他の領域と連絡する経路として、
VTAからはドーパミンを介して、側坐核、扁桃および前頭皮質へ、
グルタミンを介して、扁桃、海馬および前頭皮質から側坐核へ、
GABA(ガンマーアミノ酪酸、中枢神経における抑制系神経伝達物質)を介して、側坐核からVTA
これらの経路は、薬物への渇望感やストレスがあると再発しやすくなる、薬物を暗示するものに過敏に反応することなどに関わっている。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳④
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
ドーパミンの大洪水
依存性の薬物は化学構造の上で共通した特徴はなく、身体に及ぼす効果も様々だ。
それなのに、なぜ脳の報酬回路に全く同じ効果をもたらすのだろうか?
心臓を疾駆させる興奮剤のコカインと苦痛を抑える鎮静剤のヘロインは全く逆の方向に作用するのに、どうして報酬系には同じように働くのだろう。
その答えは、どの乱用薬物の場合も、側坐核にドーパミンやそれに似たシグナルが大量に流れ込むようになるからだ。
VTA(腹側被蓋野)のニューロンが興奮すると、電気的な信号が軸索を流れる。
軸索は側坐核へと繋がるハイウェイのようなものだ。
この電気シグナルが軸索の末端にあるシナプスに届くと、そこからドーパミンが放出される。
シナプスは、狭い空間(シナプス間隙)に放出されたドーパミンは側坐核のニューロン上にある受容体にとらえられ、細胞内に情報を伝える。
同時に、放出した側のVTAニューロンが再利用のためにドーパミンを回収する。
こうしてシナプス間隙からドーパミンが停止する。
コカインを始めとする興奮剤は、VTAニューロンがドーパミンを回収するときに使うトランスポーター分子(輸送体)を一時的に阻害する。
そのために過剰なドーパミンが側坐核に働いてしまう。
一方、ヘロインなどのオピエート(アヘン類、オピオイド)は、VTA内にあるドーパミン放出ニューロンとは別のニューロンに結合する。
このニューロンは本来はドーパミン放出ニューロンの機能を抑える働きをするが、オピエートはこの締め付けを解いてしまう。
このため、やはり余分なドーパミンが側坐核に流れ込んでしまう。
またオピエートは、側坐核に直接働いて強い「報酬」信号を発生させる。
しかし薬物はドーパミンの過剰放出を引き起こして快感をもたらしたり、最初の報酬シグナルを仲介したり強化するだけではない。
なんども薬物にさらされると、報酬回路の方が、次第に薬物のある状態に慣れて順応してしまう。
これが依存を生じさせる。
薬物で脳のどこが影響を受けるか
薬物を慢性的に使うと、報酬回路の一番重要な部分で活動や構造が変化する。
その部分とはVTA(腹側被蓋野)のドーパミンを作るニューロンから側坐核のドーパミンを受ける細胞への経路だ。
この変化は、下記の分子反応によって誘導される。
CREB(記憶に必要なたの遺伝子を調節し、長期記憶形成に必要なタンパク質):耐性の原因
VTAにあるドーパミンを放出ニューロンが興奮すると、ドーパミンが神経末端から放出され、側坐核のシナプス受容体にはまる(ドーパミンシグナル)と、細胞内にcAMP(サイクリックAMP、細胞内情報伝達物質)とCaイオン濃度が上昇し、CREBが即座に活性化される。
CREBは、DNAに結合して特定の遺伝子群を活性化し、記憶形成に関わるタンパク質を合成する。
例えばダイノルフィンというタンパク質がVTAに向けて放出されると、VTAではドーパミンの放出が抑えられ、報酬回路も抑制される。
こうなると、依存症の患者はハイな気分になろうとしてもっと薬物を求めるようになる。
ΔFosB(デルタFosB):渇望感の原因
ドーパミンシグナルがΔFosBタンパク質の合成を引き起こす。
ΔFosBはダイノルフィンの合成を抑制し、特定の遺伝子群を活性化する(CREBによって活性化されるものとは別の遺伝子群)。
活性化された遺伝子群は、薬物や薬物関連の事物に対する敏感さに関わるタンパク質を作る。
例えばCDK5というタンパク質は、側坐核の神経を持続的に薬物過敏にしたり、薬物関連の手がかりに対して過敏になるような構造変化を促進させる。
効かない・効きすぎるーその差を決めるタイミング
薬物の効きが悪くなる(耐性)か、
逆に過敏になる(感受性が高くなる)かは、
側坐核のニューロン内にある活性型CREBとΔFosBの濃度が関係しているようだ。
最初はCREBの濃度が高く、耐性が生じて、以前の使用量ではハイな気分を味わえなくなる。
薬物が体内からなくなると不快感が現れ、これをなくすにはもっと多くの薬物が必要となる。
しかしCREBの活性は、繰り返し摂取しない限り、数日間で落ちていく。
これとは反対に、ΔFosB濃度は一度上昇すると、最後の薬物摂取から数週間経っても高いまま維持される。
CREB活性が低下してくると、ΔFosBの持つ危険な長期的感受性の高まりが主流になる。
この一連の反応が、耐性や依存、薬物を求める強い渇望感を引き起こす。
一旦変化が起きると長期間、薬物を辞めていても再発しやすい。
これにも、この反応が関与している。
側坐核とVTAが、他の領域と連絡する経路として、
VTAからはドーパミンを介して、側坐核、扁桃および前頭皮質へ、
グルタミンを介して、扁桃、海馬および前頭皮質から側坐核へ、
GABA(ガンマーアミノ酪酸、中枢神経における抑制系神経伝達物質)を介して、側坐核からVTA
これらの経路は、薬物への渇望感やストレスがあると再発しやすくなる、薬物を暗示するものに過敏に反応することなどに関わっている。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月04日
ドラッグに翻弄される脳③
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳③
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
脳の報酬系が薬物で活性化する
哺乳類の報酬回路はもっと複雑だ。
報酬回路は脳の幾つかの領域にわたって組み込まれている。
例えば食事やセックス、仲間とのやりとりなどの刺激に対してどう反応するかを指令する領域や、体験した出来事に対して感情を呼び起こす領域などだ。
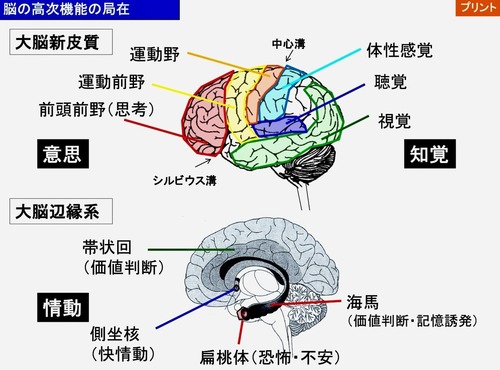
具体的には、扁桃や海馬などだ。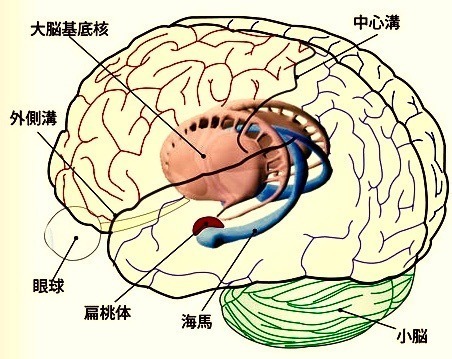
扁桃はその経験が快いものか嫌なものか、繰り返すべきか避けるべきか、ということを評価し、経験とそれを想起させる手がかりとを関連付ける働きがある。
また、海馬にはいつどこで誰と経験したかという記憶が書き込んである。
そして大脳皮質の前頭葉は、これらすべての情報を統合して処理し、最終的にその人の行動を決定する。
VTA(腹側被蓋野)―側坐核経路は、報酬の調節器のように機能する。
他の脳のセンターに「その行為にどれだけ報いるべきか」を「告げる」のだ。
この経路がその行為は報酬を受けるべきだと見なしたら、生物はその行為をよりよく覚え、繰り返しするようになる。
脳の報酬回路についてわかっていることの多くは動物実験で得られたものだが、この10年で、ヒトでも同じ経路が報酬を調節していることがわかってきた。
それは正常な反応でも薬物による快感でも同じだった。
こうした研究を支えているのは、脳の画像診断技術の発達だ。
脳のニューロンの活動が高まると血流量が増す
機能的核磁気共鳴画像装置(fMRI)や陽電子放出断層撮影装置(PET)はこうした血流量の変化を測定する。
これらの装置によって、コカイン依存症患者がコカインを摂取した時の側坐核が観察された。
また、同じ患者が、誰かがコカインを吸っているビデオを見たり、白い粉の写真を見たりした時に脳で起きている反応も調べられている。
すると、実際に摂取している時もビデオや写真の時も側坐核は同様に反応し、扁桃や皮質の一部の領域も同様に活動が高まった。
賭け事を止められないギャンブル依存症患者にスロットマシンの映像を見せた時も、同じ領域が同様に活性化する。
VTA―側坐核経路は薬物以外の常習行動にも重要な役割を果たしているようだ。
薬物依存に関するキーワード
依存と中毒:薬物や化学物質などが原因で、体に悪影響が生じるのが「中毒」。
いわゆる“一気飲み”による急性アルコール中毒はこの典型だ。
依存は本人が止めたいと思っても止められなくなった状態をいう。
離脱症状・退薬症状・禁断症状:繰り返し薬物を使っていると“薬漬け”の状態に体が慣れてしまい、薬物が体内から無くなると、震えや悪寒、吐き気などが起きたり、うつ状態になったりする。
これを離脱症状とか、退薬症状と呼ぶ。
いわゆる「禁断症状」と同じだが、薬物を中断していなくても(量を減らしたり、ずっと同じ量を使い続けていたりすると)この症状に苦しめられることがある。
身体依存と精神依存:薬物が体内からなくなっていくときに、上の項の離脱症状が現れるのが身体依存。
これに対し、薬物が欲しくて、常時薬物のことしか考えられなくなったり、薬物を得るための行動(薬物探索行動)を脅迫的に繰り返す状態になったりすることを精神的依存という。
コカインのように身体依存はそれほどはっきりしないものもあるが、常習性のある薬物は全て精神依存を引き起こす。
精神毒性:本文ではほとんど触れていないが、薬物などの影響で仕事や家事、車の運転など日常的なことを行う能力が低下することがある。
これを精神的毒性と呼び、慢性と急性がある。
アルコールや覚せい剤には精神毒性があるが、同じ依存を引き起こす物質でもニコチンには精神毒性はないとされている。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳③
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
脳の報酬系が薬物で活性化する
哺乳類の報酬回路はもっと複雑だ。
報酬回路は脳の幾つかの領域にわたって組み込まれている。
例えば食事やセックス、仲間とのやりとりなどの刺激に対してどう反応するかを指令する領域や、体験した出来事に対して感情を呼び起こす領域などだ。
具体的には、扁桃や海馬などだ。

扁桃はその経験が快いものか嫌なものか、繰り返すべきか避けるべきか、ということを評価し、経験とそれを想起させる手がかりとを関連付ける働きがある。
また、海馬にはいつどこで誰と経験したかという記憶が書き込んである。
そして大脳皮質の前頭葉は、これらすべての情報を統合して処理し、最終的にその人の行動を決定する。
VTA(腹側被蓋野)―側坐核経路は、報酬の調節器のように機能する。
他の脳のセンターに「その行為にどれだけ報いるべきか」を「告げる」のだ。
この経路がその行為は報酬を受けるべきだと見なしたら、生物はその行為をよりよく覚え、繰り返しするようになる。
脳の報酬回路についてわかっていることの多くは動物実験で得られたものだが、この10年で、ヒトでも同じ経路が報酬を調節していることがわかってきた。
それは正常な反応でも薬物による快感でも同じだった。
こうした研究を支えているのは、脳の画像診断技術の発達だ。
脳のニューロンの活動が高まると血流量が増す
機能的核磁気共鳴画像装置(fMRI)や陽電子放出断層撮影装置(PET)はこうした血流量の変化を測定する。
これらの装置によって、コカイン依存症患者がコカインを摂取した時の側坐核が観察された。
また、同じ患者が、誰かがコカインを吸っているビデオを見たり、白い粉の写真を見たりした時に脳で起きている反応も調べられている。
すると、実際に摂取している時もビデオや写真の時も側坐核は同様に反応し、扁桃や皮質の一部の領域も同様に活動が高まった。
賭け事を止められないギャンブル依存症患者にスロットマシンの映像を見せた時も、同じ領域が同様に活性化する。
VTA―側坐核経路は薬物以外の常習行動にも重要な役割を果たしているようだ。
薬物依存に関するキーワード
依存と中毒:薬物や化学物質などが原因で、体に悪影響が生じるのが「中毒」。
いわゆる“一気飲み”による急性アルコール中毒はこの典型だ。
依存は本人が止めたいと思っても止められなくなった状態をいう。
離脱症状・退薬症状・禁断症状:繰り返し薬物を使っていると“薬漬け”の状態に体が慣れてしまい、薬物が体内から無くなると、震えや悪寒、吐き気などが起きたり、うつ状態になったりする。
これを離脱症状とか、退薬症状と呼ぶ。
いわゆる「禁断症状」と同じだが、薬物を中断していなくても(量を減らしたり、ずっと同じ量を使い続けていたりすると)この症状に苦しめられることがある。
身体依存と精神依存:薬物が体内からなくなっていくときに、上の項の離脱症状が現れるのが身体依存。
これに対し、薬物が欲しくて、常時薬物のことしか考えられなくなったり、薬物を得るための行動(薬物探索行動)を脅迫的に繰り返す状態になったりすることを精神的依存という。
コカインのように身体依存はそれほどはっきりしないものもあるが、常習性のある薬物は全て精神依存を引き起こす。
精神毒性:本文ではほとんど触れていないが、薬物などの影響で仕事や家事、車の運転など日常的なことを行う能力が低下することがある。
これを精神的毒性と呼び、慢性と急性がある。
アルコールや覚せい剤には精神毒性があるが、同じ依存を引き起こす物質でもニコチンには精神毒性はないとされている。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月03日
ドラッグに翻弄される脳②
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳②
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
動物も薬物依存症になる
それだけでなく、動物たちはついには薬物依存行動をとるようになる。
文字通り寝食を忘れて薬物を摂取するようになり、消耗したり栄養失調で死ぬまで続けたりする。
コカインなど常習性薬物の場合、動物たちは目覚めている限りずっとこれを求め続け、何百回に1回ようやく薬物が出るように設定してあってもレバーを押し続ける(この実験は諦めるまでの回数によって、欲求の強さを見る)。
そして依存症患者が薬物に関連した道具を見たり、以前に薬物を入手した場所に通りかかったりした時に経験する強い渇望感を実験動物も感じるようなのだ。
飼育箱をつなげておいて、どれにはるかを自分で選べるようにすると、実験動物たちはレバーを押せばいつも薬物が得られた箱を選ぶ。
薬物が得られないとわかると、動物たちは薬物摂取のための行動をすぐに止める。
しかし、快楽は忘れない。
数ヶ月間も薬物がない環境に置かれたラットでも、ちょっとコカインを与えたり、薬物を思い出させるような場所に置かれたりするとすぐにレバーを押し始める。
また、例えば不意打ちで繰り返す電気ショックのような心理的ストレスが加わると、すぐに薬物依存に戻ってしまう。
実験動物は少量の薬物や薬物を思い出させる事物、そしてストレスなどが引き金となって薬物への強い渇望感を抱き、再発する。
これは、人間でも全く同じだ。
これらの動物実験によって、脳のどこの場所が乱用行動を引き起こすのかを特定でき、報酬回路の役割が明らかになってきた。
薬物を摂取すると、脳の報酬回路が活性化するが、その活性状態は食事やセックスといった快楽をもたらす他のどんな行動のときよりも強く、長く続く。
報酬回路でカギを握っているのは、脳の辺縁系にあるドーパミンシステムだ。
これらは、脳の最深部に近い腹側被蓋野(VTA)に端を発するニューロン群で、前頭葉のすぐ下にある側坐核に向けて軸索を伸ばしている。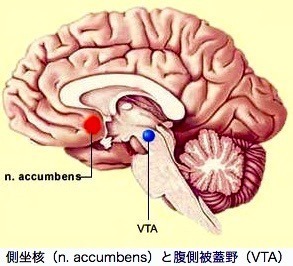
VTAから側坐核へのドーパミンの流れは、薬物乱用に決定的な役割を果たしている。
実際、実験動物でこれらの領域を傷つけると、もはや薬物には興味を示さなくなるのだ。
報酬回路の起源は古い
体の構造がごく単純な線虫(C. elegans)にも原始的な報酬回路がある。
線虫では、8個のドーパミン系ニューロンのうちの4個を不活性化すると、餌である好物のバクテリアに見向きもせずに通り過ぎるようになる。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳②
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのは
なぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
動物も薬物依存症になる

それだけでなく、動物たちはついには薬物依存行動をとるようになる。
文字通り寝食を忘れて薬物を摂取するようになり、消耗したり栄養失調で死ぬまで続けたりする。
コカインなど常習性薬物の場合、動物たちは目覚めている限りずっとこれを求め続け、何百回に1回ようやく薬物が出るように設定してあってもレバーを押し続ける(この実験は諦めるまでの回数によって、欲求の強さを見る)。
そして依存症患者が薬物に関連した道具を見たり、以前に薬物を入手した場所に通りかかったりした時に経験する強い渇望感を実験動物も感じるようなのだ。
飼育箱をつなげておいて、どれにはるかを自分で選べるようにすると、実験動物たちはレバーを押せばいつも薬物が得られた箱を選ぶ。
薬物が得られないとわかると、動物たちは薬物摂取のための行動をすぐに止める。
しかし、快楽は忘れない。
数ヶ月間も薬物がない環境に置かれたラットでも、ちょっとコカインを与えたり、薬物を思い出させるような場所に置かれたりするとすぐにレバーを押し始める。

また、例えば不意打ちで繰り返す電気ショックのような心理的ストレスが加わると、すぐに薬物依存に戻ってしまう。
実験動物は少量の薬物や薬物を思い出させる事物、そしてストレスなどが引き金となって薬物への強い渇望感を抱き、再発する。
これは、人間でも全く同じだ。
これらの動物実験によって、脳のどこの場所が乱用行動を引き起こすのかを特定でき、報酬回路の役割が明らかになってきた。
薬物を摂取すると、脳の報酬回路が活性化するが、その活性状態は食事やセックスといった快楽をもたらす他のどんな行動のときよりも強く、長く続く。
報酬回路でカギを握っているのは、脳の辺縁系にあるドーパミンシステムだ。
これらは、脳の最深部に近い腹側被蓋野(VTA)に端を発するニューロン群で、前頭葉のすぐ下にある側坐核に向けて軸索を伸ばしている。

VTAから側坐核へのドーパミンの流れは、薬物乱用に決定的な役割を果たしている。
実際、実験動物でこれらの領域を傷つけると、もはや薬物には興味を示さなくなるのだ。
報酬回路の起源は古い
体の構造がごく単純な線虫(C. elegans)にも原始的な報酬回路がある。
線虫では、8個のドーパミン系ニューロンのうちの4個を不活性化すると、餌である好物のバクテリアに見向きもせずに通り過ぎるようになる。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月02日
ドラッグに翻弄される脳①
最終的には、心の働きの脳内メカニズムについて述べていきます。
ドラッグに翻弄される脳①
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのはなぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
注射針や白い粉。
多くの薬物常習者は、薬物そのものの映像や薬物を連想させる道具を見ただけで、薬がもたらす快楽を思い起こして身震いする。
そして、薬物注射は本当の快感をもたらしてくれる。
高揚感、澄み切った明るさ、幻覚、安心感、宇宙の中心にいるような感覚。
短時間のうちに、全てが心地よくなる。
ヘロインやコカイン、ウイスキー、覚せい剤―。
しかし、これらが繰り返し体内に入るとそれ以上の変化を引き起こす。
やがて以前の量では幸福感が得られなくなる。
それどころか、ただ普通の状態でいるために一服が必要となる。
さもなければ、抑うつ状態になり、肉体的に病んでしまうことさえある。
こうして、脅迫的な薬物常習者が生まれてしまう。
この段階で依存症に陥っており、薬物使用に対して抑制が利かなくなる。
薬物を使い始めた頃のスリルはとうになくなり、健康は蝕まれ、薬物を買うために金も失い、家族や友人との人間関係までもが壊れた後でさえ、患者は薬を求めて強い渇望感に悩まされる。
薬物がもたらす幸福感は全て、これらの化学物質が最終的に「脳の報酬系」を高める働きをするからだという事実が以前から知られていた。
脳の報酬系とは、神経細胞(ニューロン)が作る複雑な神経回路の1つで、食事やセックスなどをすると興奮する。
つまり、私たちが生き延びて遺伝子を子孫に伝えるのに不可欠な行動をすると、快感を覚えるように進化した回路だ。
少なくとも始めのうちは、この系を刺激することは私たちに快感をもたらし、そうした快楽をもたらしてくれる行動なら、どんな行動でも反復するよう私たちは駆り立てられる。
しかし、慢性的に薬物を使用すると、報酬系のニューロンの構造や機能に変化が生じ、その変化は最後の注射の後、数週間から数ヶ月、あるいは数年も持続してしまうことが最近の研究からわかってきた。
こうした順応の結果、生憎なことに、薬物を繰り返し乱用しても快楽が得にくくなり、渇望感がエスカレートしていく。
薬物常習者が家庭や職場でトラブルを起こしながら、破滅の道への悪循環に陥るのはこのためだ。
しかし、薬物が引き起こす脳での変化についての理解が深まり、乱用を止める良い方策が示されるようになってきた。
薬物の虜になった人たちにも、脳をもとに戻し、人生をやり直す道が開けてきそうだ。
様々な乱用薬物が共通の神経回路を介して最終的に常習をもたらす。
このことがわかってきたのは、50数年前、当時はミシガン大学にいた柳田知司(やなぎだ・ともじ)らが行った動物実験の成果による。
マウスやラット、サルといった実験動物も、ヒトが依存症に陥るのと同じ薬物を、自ら摂取するようになる。
実験では、あるレバーを動物が押すと、静脈につながったチューブから薬物が流れ込むようにしてある。
別のレバーを押すと生理食塩水、さらに別のレバーは餌が出るようになっている。
2~3日もすると、実験動物はコカインやヘロイン、アンフェタミンなどの薬物だけを摂り始めるようになった。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
ドラッグに翻弄される脳①
辞めたいと思ってもやめられない依存症を引き起こし、再発しやすいのはなぜだろう
実は薬物は脳の報酬系という神経回路を変えてしまう
しかもその変化は乱用を止めた後でも長期にわたって続くことがわかってきた
E. J. ネスラー(テキサス大学)/R. C. マレンカ(スタンフォード大学)
注射針や白い粉。
多くの薬物常習者は、薬物そのものの映像や薬物を連想させる道具を見ただけで、薬がもたらす快楽を思い起こして身震いする。
そして、薬物注射は本当の快感をもたらしてくれる。
高揚感、澄み切った明るさ、幻覚、安心感、宇宙の中心にいるような感覚。
短時間のうちに、全てが心地よくなる。
ヘロインやコカイン、ウイスキー、覚せい剤―。
しかし、これらが繰り返し体内に入るとそれ以上の変化を引き起こす。
やがて以前の量では幸福感が得られなくなる。
それどころか、ただ普通の状態でいるために一服が必要となる。
さもなければ、抑うつ状態になり、肉体的に病んでしまうことさえある。
こうして、脅迫的な薬物常習者が生まれてしまう。
この段階で依存症に陥っており、薬物使用に対して抑制が利かなくなる。
薬物を使い始めた頃のスリルはとうになくなり、健康は蝕まれ、薬物を買うために金も失い、家族や友人との人間関係までもが壊れた後でさえ、患者は薬を求めて強い渇望感に悩まされる。
薬物がもたらす幸福感は全て、これらの化学物質が最終的に「脳の報酬系」を高める働きをするからだという事実が以前から知られていた。
脳の報酬系とは、神経細胞(ニューロン)が作る複雑な神経回路の1つで、食事やセックスなどをすると興奮する。
つまり、私たちが生き延びて遺伝子を子孫に伝えるのに不可欠な行動をすると、快感を覚えるように進化した回路だ。
少なくとも始めのうちは、この系を刺激することは私たちに快感をもたらし、そうした快楽をもたらしてくれる行動なら、どんな行動でも反復するよう私たちは駆り立てられる。
しかし、慢性的に薬物を使用すると、報酬系のニューロンの構造や機能に変化が生じ、その変化は最後の注射の後、数週間から数ヶ月、あるいは数年も持続してしまうことが最近の研究からわかってきた。
こうした順応の結果、生憎なことに、薬物を繰り返し乱用しても快楽が得にくくなり、渇望感がエスカレートしていく。
薬物常習者が家庭や職場でトラブルを起こしながら、破滅の道への悪循環に陥るのはこのためだ。
しかし、薬物が引き起こす脳での変化についての理解が深まり、乱用を止める良い方策が示されるようになってきた。
薬物の虜になった人たちにも、脳をもとに戻し、人生をやり直す道が開けてきそうだ。
様々な乱用薬物が共通の神経回路を介して最終的に常習をもたらす。
このことがわかってきたのは、50数年前、当時はミシガン大学にいた柳田知司(やなぎだ・ともじ)らが行った動物実験の成果による。
マウスやラット、サルといった実験動物も、ヒトが依存症に陥るのと同じ薬物を、自ら摂取するようになる。
実験では、あるレバーを動物が押すと、静脈につながったチューブから薬物が流れ込むようにしてある。
別のレバーを押すと生理食塩水、さらに別のレバーは餌が出るようになっている。
2~3日もすると、実験動物はコカインやヘロイン、アンフェタミンなどの薬物だけを摂り始めるようになった。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年05月01日
加齢マウスの記憶を改善
最終的には、心の働きの脳内メカニズムについて述べていきます。
連想を生むーニューロン集団⑦
異なる記憶の関連付けは
私たちが周囲の世界を理解したり体系化したりする上で重要だ
技術革命によって記憶を関連付けるプロセスが明らかになってきた
A.J.シルバ(カルフォルニア大学ロサンゼルス校)
加齢マウスの記憶を改善
次に、私たちはより高齢のマウスで記憶の関連付けを調べることにした。
若いマウスに比べると、高齢のマウスは海馬のCA1領域のニューロンを含め脳内のCREB濃度が低く、興奮性も低い。
このことから私たちは、高齢のマウスには記憶の関連付けは難しいだろうと予想した。
カイらはそれまでに実施した実験の多くを加齢マウスで繰り返した。
結果は驚くものだった。
経験の長い研究者なら、仮説はツールに過ぎないことを知っており、正しいとは必ずしも期待していない。
間違いは避けられず、間違いによって仮説は修正されていく。
だがこの時は私たちの勘が正しかった。
カイが少々息を切らせながら私のオフィスに飛び込んできた時のことを私は今でも覚えている。
彼女は、加齢マウスは2つの箱に入れた間隔が5時間と短い場合、個々の箱のことは覚えているが、記憶を関連付けるのが困難だと言った。
5時間といえば、若いマウスなら難なく記憶の関連付けができた間隔だ。
加齢マウスのミニスコープ画像から、それぞれの記憶に対応する細胞集団の重複が若いマウスに比べて少ないことが判明した。
私たちはこの結果に興奮したが、本当かどうか疑わしいと思い、すぐに実験を繰り返した。
2回目の実験では、さらに説得力のある結果が得られた。
CREB濃度の低い加齢マウスのニューロンは、若いマウスのようには記憶を関連付けられなかった。
これらの結果に勇気付けられ、私たちは研究の範囲を広げた。
加齢マウスが2つの箱を探索している時に一部のCA1ニューロンの興奮性を人為的に高めることにより、最初の箱で活性化したCA1ニューロンの一部を2番目の箱でも確実に活性化させることはできるだろうか?
この実験を実行するため、私たちは細胞表面にある受容体の遺伝子を組み換えることで細胞の機能を制御する画期的な技術を使った。
DREADD(デザイナー薬剤に選択的に応答するデザイナー受容体)と呼ばれる技術だ。
マウスが2つの箱を探索している時、それぞれDREADD受容体を活性化すると、同じCA1ニューロン集団を活性化でき、その結果、2つの箱の記憶を関連づけることができた。
正直言って、私は当初、この実験のアイデアは馬鹿げていると思っていた。
失敗してもおかしくなかった理由はいくつもある。
まず、場所の記憶にはCA1領域だけでなく、相互接続した多数の脳領域に存在する何百万個のニューロンが関与している。
これ位によって、これらの領域のすべてではないにしても、多くで記憶の関連づけプロセスが衰えているとも考えられる。
だから一部のCA1ニューロンの興奮性を高めることができても、それだけでは不十分かもしれないし、ニューロンに誘導する興奮性のレベルが不足する可能性もある。
だが、実験はうまくいった。
こうした一か八かの試みがカギになるのは、時間及び資金の投資と、得られるかもしれない結果のバランスだ。
とはいうものの、今回は運が味方してくれたと言える。
私たちは加齢マウスのCA1ニューロンの特定集団の興奮性を再び高めることによって、2つの記憶を多くの同じCA1ニューロンに割り当て、結果として加齢マウスの記憶の関連づけを回復させることができた。
ある記憶がどのようにして別の記憶と関連付けられるのか、この点についても他のチームが行ったラットやヒトの研究から解明が進んだ。
ボストン大学の神経科学者アイケンバウム(Howard Eichenbaum)は、ラットは中身が共通する記憶どうしの関連性を見出すことができることを示した。
テキサス大学オースティン校の神経科学者プレストン(Alison Preston)らは、記憶の中身が共通する場合、ヒトはそれらの記憶をより容易に関連づけられることを明らかにした。
一方の記憶の想起によって、他方の記憶が思い出されるからだろう。
ニューロンの活動を測定・制御するのに使えるツールが増えたことで、脳が情報の体系化に用いているメカニズムが明らかになりつつある。
私たちのチームは現在、新しい方法でこの研究を拡張しようとしている。
ギリシャにあるヘラス研究技術財団分子生物学バイオテクノロジー研究所の計算神経科学者ポイラジ(Panayiota Poirazi)と共に、記憶がいつどのように関連付けられるかをシュミレートするコンピューターモデルを作っているところだ。
さらに、様々な脳領域において、記憶の関連づけに必要な時間間隔を制御しているメカニズムの解明にも取り組んでいる。
今の所、複数の研究チームによって行われた広範囲に及ぶ実験は全て「割り当てー関連づけ仮説」を強く支持している。
記憶がどう絡み合うかを理解することは、加齢に関連した認知機能の低下から、統合失調症、鬱、双極性障害まで、精神疾患に広く共通して見られる記憶障害の治療法の開発に役立つと私たちは期待している。
臨床的な意義以外にも、本稿で紹介した研究は、記憶に関する研究の胸躍る新時代を反映している。
記憶の研究は今や、私たちの想像力不足が限界となっても、技術的問題で実験が制限されることはない。
監修 井ノ口馨(いのくち・かおる)
著者 Alcino J. Silva
カリフォルニア大学ロサンゼルス校の特別教授で、同大学学習と記憶の統合研究センター長。
彼の研究室(www.silvalab.org)は、記憶のメカニズム及び記憶障害の原因と治療法を研究している。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
連想を生むーニューロン集団⑦
異なる記憶の関連付けは
私たちが周囲の世界を理解したり体系化したりする上で重要だ
技術革命によって記憶を関連付けるプロセスが明らかになってきた
A.J.シルバ(カルフォルニア大学ロサンゼルス校)
加齢マウスの記憶を改善
次に、私たちはより高齢のマウスで記憶の関連付けを調べることにした。
若いマウスに比べると、高齢のマウスは海馬のCA1領域のニューロンを含め脳内のCREB濃度が低く、興奮性も低い。
このことから私たちは、高齢のマウスには記憶の関連付けは難しいだろうと予想した。
カイらはそれまでに実施した実験の多くを加齢マウスで繰り返した。
結果は驚くものだった。
経験の長い研究者なら、仮説はツールに過ぎないことを知っており、正しいとは必ずしも期待していない。
間違いは避けられず、間違いによって仮説は修正されていく。
だがこの時は私たちの勘が正しかった。
カイが少々息を切らせながら私のオフィスに飛び込んできた時のことを私は今でも覚えている。
彼女は、加齢マウスは2つの箱に入れた間隔が5時間と短い場合、個々の箱のことは覚えているが、記憶を関連付けるのが困難だと言った。
5時間といえば、若いマウスなら難なく記憶の関連付けができた間隔だ。
加齢マウスのミニスコープ画像から、それぞれの記憶に対応する細胞集団の重複が若いマウスに比べて少ないことが判明した。
私たちはこの結果に興奮したが、本当かどうか疑わしいと思い、すぐに実験を繰り返した。
2回目の実験では、さらに説得力のある結果が得られた。
CREB濃度の低い加齢マウスのニューロンは、若いマウスのようには記憶を関連付けられなかった。
これらの結果に勇気付けられ、私たちは研究の範囲を広げた。
加齢マウスが2つの箱を探索している時に一部のCA1ニューロンの興奮性を人為的に高めることにより、最初の箱で活性化したCA1ニューロンの一部を2番目の箱でも確実に活性化させることはできるだろうか?
この実験を実行するため、私たちは細胞表面にある受容体の遺伝子を組み換えることで細胞の機能を制御する画期的な技術を使った。
DREADD(デザイナー薬剤に選択的に応答するデザイナー受容体)と呼ばれる技術だ。
マウスが2つの箱を探索している時、それぞれDREADD受容体を活性化すると、同じCA1ニューロン集団を活性化でき、その結果、2つの箱の記憶を関連づけることができた。
正直言って、私は当初、この実験のアイデアは馬鹿げていると思っていた。
失敗してもおかしくなかった理由はいくつもある。
まず、場所の記憶にはCA1領域だけでなく、相互接続した多数の脳領域に存在する何百万個のニューロンが関与している。
これ位によって、これらの領域のすべてではないにしても、多くで記憶の関連づけプロセスが衰えているとも考えられる。
だから一部のCA1ニューロンの興奮性を高めることができても、それだけでは不十分かもしれないし、ニューロンに誘導する興奮性のレベルが不足する可能性もある。
だが、実験はうまくいった。
こうした一か八かの試みがカギになるのは、時間及び資金の投資と、得られるかもしれない結果のバランスだ。
とはいうものの、今回は運が味方してくれたと言える。
私たちは加齢マウスのCA1ニューロンの特定集団の興奮性を再び高めることによって、2つの記憶を多くの同じCA1ニューロンに割り当て、結果として加齢マウスの記憶の関連づけを回復させることができた。
ある記憶がどのようにして別の記憶と関連付けられるのか、この点についても他のチームが行ったラットやヒトの研究から解明が進んだ。
ボストン大学の神経科学者アイケンバウム(Howard Eichenbaum)は、ラットは中身が共通する記憶どうしの関連性を見出すことができることを示した。
テキサス大学オースティン校の神経科学者プレストン(Alison Preston)らは、記憶の中身が共通する場合、ヒトはそれらの記憶をより容易に関連づけられることを明らかにした。
一方の記憶の想起によって、他方の記憶が思い出されるからだろう。
ニューロンの活動を測定・制御するのに使えるツールが増えたことで、脳が情報の体系化に用いているメカニズムが明らかになりつつある。
私たちのチームは現在、新しい方法でこの研究を拡張しようとしている。
ギリシャにあるヘラス研究技術財団分子生物学バイオテクノロジー研究所の計算神経科学者ポイラジ(Panayiota Poirazi)と共に、記憶がいつどのように関連付けられるかをシュミレートするコンピューターモデルを作っているところだ。
さらに、様々な脳領域において、記憶の関連づけに必要な時間間隔を制御しているメカニズムの解明にも取り組んでいる。
今の所、複数の研究チームによって行われた広範囲に及ぶ実験は全て「割り当てー関連づけ仮説」を強く支持している。
記憶がどう絡み合うかを理解することは、加齢に関連した認知機能の低下から、統合失調症、鬱、双極性障害まで、精神疾患に広く共通して見られる記憶障害の治療法の開発に役立つと私たちは期待している。
臨床的な意義以外にも、本稿で紹介した研究は、記憶に関する研究の胸躍る新時代を反映している。
記憶の研究は今や、私たちの想像力不足が限界となっても、技術的問題で実験が制限されることはない。
監修 井ノ口馨(いのくち・かおる)
著者 Alcino J. Silva
カリフォルニア大学ロサンゼルス校の特別教授で、同大学学習と記憶の統合研究センター長。
彼の研究室(www.silvalab.org)は、記憶のメカニズム及び記憶障害の原因と治療法を研究している。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
2019年04月30日
記憶にタグ付け
最終的には、心の働きの脳内メカニズムについて述べていきます。
連想を生むーニューロン集団⑥
異なる記憶の関連付けは
私たちが周囲の世界を理解したり体系化したりする上で重要だ
技術革命によって記憶を関連付けるプロセスが明らかになってきた
記憶にタグ付け
ミニスコープの結果をさらに確認するために、カイは神経科学者メイフォード(Mark Mayford, 現カリフォルニア大学サンディエゴ校)が開発した別の手法を用いた。TetTagシステムと呼ばれる技術だ(TetTag はテトラサイクリン・タグの略)。
特殊な遺伝子改変を施したマウスが箱内を探索している時に記憶が形成されると、活性化したニューロンではTetTag によって蛍光タンパクが作られて蛍光を発するようになり、それが何週間も消えずに残る。
マウスの死後に、最近活性化したニューロン(記憶の形成直後に発現する遺伝子によって標識されたニューロン)と、TetTag によって長期間タグ付けされたニューロンを対比できる。
ある1つの出来事で活性化されたニューロンには1個の蛍光タグが付き、2つの出来事によって活性化されたニューロンには両方の蛍光タグが付いているので、それぞれを特定できるのだ。
カイらはこの可視化法を使って以前と同じ実験を行い、時間感覚が5時間と短い場合、2つの記憶を記録したニューロン集団の重複(2つのタグがついたニューロン)は、偶然によって生じる水準よりもかなり多いことを示した。
間隔が7日間の場合、ニューロン集団の重複は、偶然による場合と有意な差はなかった。
私たちの「記憶の関連付け仮説」を裏付けるさらなる証拠が、トロント大学のジョセリンのチームによる実験で得られた。
彼女らはニューロンをタグ付けする別バージョンの実験を行っただけでなく、独立の行動実験からも、記憶の関連付けの証拠を得た。
ジョセリンらは、2つの記憶のそれぞれを記憶しているニューロン集団に重複があるなら、1番目の記憶によって引き起こされたCREB濃度の増加は2番目の記憶も強化するだろうと予想した。
ただし私たちの実験のようにマウスを異なる箱に入れるのではなく、2つの異なる音を認識できるようにマウスを訓練した。
それぞれの音の訓練を6時間以内に行った場合、1番目の音の訓練によって2番目の音の記憶が強化された。
だが訓練間隔が6~24時間の場合には強化されなかった。
最近、富山大学の井ノ口馨らはさらに進んだ実験を実施した。
2つの異なる情動的記憶の両方を割り当てられた細胞集団の光遺伝学の技術を使って不活性化し、どちらか一方のみを割り当てられた細胞など他の細胞はそのままにした。
2つの記憶に共通する細胞を不活性化すると、個々の記憶の想起には影響はなかったものの、2つの記憶の結びつけが切り離された。
この見事な実験は、2つの記憶の関連付けには両者に共通するニューロン集団が必要だという私たちの説の直接の証拠となった。
提唱したばかりの「割り当てー関連付け仮説」に対する証拠は複数の研究チームによって独立に得られており、井ノ口らの結果もそれに加わった。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社
連想を生むーニューロン集団⑥
異なる記憶の関連付けは
私たちが周囲の世界を理解したり体系化したりする上で重要だ
技術革命によって記憶を関連付けるプロセスが明らかになってきた
記憶にタグ付け
ミニスコープの結果をさらに確認するために、カイは神経科学者メイフォード(Mark Mayford, 現カリフォルニア大学サンディエゴ校)が開発した別の手法を用いた。TetTagシステムと呼ばれる技術だ(TetTag はテトラサイクリン・タグの略)。
特殊な遺伝子改変を施したマウスが箱内を探索している時に記憶が形成されると、活性化したニューロンではTetTag によって蛍光タンパクが作られて蛍光を発するようになり、それが何週間も消えずに残る。
マウスの死後に、最近活性化したニューロン(記憶の形成直後に発現する遺伝子によって標識されたニューロン)と、TetTag によって長期間タグ付けされたニューロンを対比できる。
ある1つの出来事で活性化されたニューロンには1個の蛍光タグが付き、2つの出来事によって活性化されたニューロンには両方の蛍光タグが付いているので、それぞれを特定できるのだ。
カイらはこの可視化法を使って以前と同じ実験を行い、時間感覚が5時間と短い場合、2つの記憶を記録したニューロン集団の重複(2つのタグがついたニューロン)は、偶然によって生じる水準よりもかなり多いことを示した。
間隔が7日間の場合、ニューロン集団の重複は、偶然による場合と有意な差はなかった。
私たちの「記憶の関連付け仮説」を裏付けるさらなる証拠が、トロント大学のジョセリンのチームによる実験で得られた。
彼女らはニューロンをタグ付けする別バージョンの実験を行っただけでなく、独立の行動実験からも、記憶の関連付けの証拠を得た。
ジョセリンらは、2つの記憶のそれぞれを記憶しているニューロン集団に重複があるなら、1番目の記憶によって引き起こされたCREB濃度の増加は2番目の記憶も強化するだろうと予想した。
ただし私たちの実験のようにマウスを異なる箱に入れるのではなく、2つの異なる音を認識できるようにマウスを訓練した。
それぞれの音の訓練を6時間以内に行った場合、1番目の音の訓練によって2番目の音の記憶が強化された。
だが訓練間隔が6~24時間の場合には強化されなかった。
最近、富山大学の井ノ口馨らはさらに進んだ実験を実施した。
2つの異なる情動的記憶の両方を割り当てられた細胞集団の光遺伝学の技術を使って不活性化し、どちらか一方のみを割り当てられた細胞など他の細胞はそのままにした。
2つの記憶に共通する細胞を不活性化すると、個々の記憶の想起には影響はなかったものの、2つの記憶の結びつけが切り離された。
この見事な実験は、2つの記憶の関連付けには両者に共通するニューロン集団が必要だという私たちの説の直接の証拠となった。
提唱したばかりの「割り当てー関連付け仮説」に対する証拠は複数の研究チームによって独立に得られており、井ノ口らの結果もそれに加わった。
参考文献:別冊日経サイエンス『最新科学が解き明かす脳と心』
2017年12月16日刊
発行:日経サイエンス社 発売:日本経済新聞出版社











