新規記事の投稿を行うことで、非表示にすることが可能です。
2020年07月02日
【化学】アルキンの還元のゴロ (出題頻度3 覚えやすさ3 まとまり5 応用性2 説明3)
リンドラー死す
「接触あるんか!?罰(×)だ!」
…あんまりだなぁ。
・リンドラー→リンドラー触媒
・死す→シス体
・接触→接触還元
・あるんか→アルカン
・罰→バーチ還元
・×→トランス体と連想
・あんま→液体アンモニア中
・り→Li
・なぁ→Na
①リンドラー触媒ではcis-アルケン
②接触還元ではアルカン
③バーチ還元では液体NH3中Li又はNaと反応させるとtrans-アルケン
がそれぞれ生成する。
アルキンの還元は使う触媒や溶媒により生成物が3パターンに分かれ、それぞれ名前がついており、これを覚える必要があります。
ゴロは警官と容疑者のやり取りを想像して下さい。
(@yakugaku594)
「接触あるんか!?罰(×)だ!」
…あんまりだなぁ。
・リンドラー→リンドラー触媒
・死す→シス体
・接触→接触還元
・あるんか→アルカン
・罰→バーチ還元
・×→トランス体と連想
・あんま→液体アンモニア中
・り→Li
・なぁ→Na
①リンドラー触媒ではcis-アルケン
②接触還元ではアルカン
③バーチ還元では液体NH3中Li又はNaと反応させるとtrans-アルケン
がそれぞれ生成する。
アルキンの還元は使う触媒や溶媒により生成物が3パターンに分かれ、それぞれ名前がついており、これを覚える必要があります。
ゴロは警官と容疑者のやり取りを想像して下さい。
(@yakugaku594)
【有機化学】アルキンの還元 リンドラー死す 「接触あるんか!?罰(×)だ!」 …あんまりだなぁ。 リンドラー→リンドラー触媒 死す→シス体 接触→接触還元 あるんか→アルカン 罰→バーチ還元 ×→トランス体 あんま→液体アンモニア中 り→Li なぁ→Na 説明は続きです
— 薬剤師国家試験CBTのゴロと覚え方 (@yakugaku594) 2015, 11月 24
2020年06月11日
【化学】軌道のゴロ (出題頻度1 覚えやすさ4 得点効果3 応用性2 説明3)
方向性変わり形としてはからゼロ始まるSPEED復活
・方向性→方位量子数
・形→形状
・SPEED復活→s,p,d,f軌道の順
軌道の形状を表す方位量子数は0から始まる
s軌道 0
p軌道 1
d軌道 2
f軌道 3
2008年に復活したグループSPEEDのゴロです。
ここでは方位量子数が軌道の形状を表し、0から始まることがポイントですね。s軌道は球状、p軌道は亜鈴形、d軌道はクローバーのような形をしてます。
この範囲でもう1つ出てくる主量子数としっかり区別出来るように!
主量子数は電子殻を表し、1から始まりK殻、L殻、M殻…と続くやつでした。
国試では「主量子数3,方位量子数1に対応する軌道は3s軌道である」なんて出てきます。
一見正しそうですが方位量子は0から始まるので方位量子数1はp軌道なので答えは3s軌道ではなく3p軌道ですよね。
こういうつまらない問題には労力をかけたくないのでゴロで対応出来るようにしておくのがオススメです。
(@yakugaku594)
https://twitter.com/yakugaku594
2016年04月23日
求電子試薬と求核試薬について
前回の内容https://fanblogs.jp/yakugaku594/archive/121/0
の続きでそれぞれの試薬について例を挙げて大事なポイントをお伝えします。
【求電子反応を起こしやすい試薬】
その名の通り「電子を求める」→「電子密度が低い」試薬なので+イオン(δ+)や空軌道をもつ原子、化合物が当てはまりますね。
例えば
H+、NO2+、AlCl3、FeBR3、BF3
などが挙げられますが、これらをいちいち覚える必要はないですよね。
電子密度が低そうなものをイメージすればいいだけです。
また、H+は酸として働くことはみんな知ってますし、「AlCl3がルイス酸である」ということも大学で有機化学を履修した方は一度は耳にしたことがあるはずです。
そう、つまり「求電子反応を起こす試薬はその反応では酸(ルイス酸)として働く」ということがポイントです。
ルイス酸の定義である「電子対を受け取ることができる物質」というのはここからきているんです。
当然、「求電子性の強さ=酸性の強さ」が成り立ちます。
【求核反応を起こしやすい試薬】
先ほどとは逆に、「核を求める」→「電子密度が高い」試薬なので-イオン(δ-)やローンペアを持つ原子、化合物だということがイメージできます。
例えば
H-、OH-、RMgBr、H2O、ROH、RSH 、NH3
ここからは先ほどと同じ考え方です。
OH-やNH3が塩基性ということはみんな知っています。
つまり「求核反応を起こす試薬はその反応では塩基(ルイス塩基)として働く」ということがポイントです。
ルイス塩基の定義である「電子対を渡すことができる物質」というのはここからきています。
当然、「求核性の強さ=塩基性の強さ」が成り立ちます。
薬学部の進級・CBT・卒業試験・国家試験の個別指導家庭教師はこちら↓
https://fanblogs.jp/yakugaku594/archive/124/0?1462235527
の続きでそれぞれの試薬について例を挙げて大事なポイントをお伝えします。
【求電子反応を起こしやすい試薬】
その名の通り「電子を求める」→「電子密度が低い」試薬なので+イオン(δ+)や空軌道をもつ原子、化合物が当てはまりますね。
例えば
H+、NO2+、AlCl3、FeBR3、BF3
などが挙げられますが、これらをいちいち覚える必要はないですよね。
電子密度が低そうなものをイメージすればいいだけです。
また、H+は酸として働くことはみんな知ってますし、「AlCl3がルイス酸である」ということも大学で有機化学を履修した方は一度は耳にしたことがあるはずです。
そう、つまり「求電子反応を起こす試薬はその反応では酸(ルイス酸)として働く」ということがポイントです。
ルイス酸の定義である「電子対を受け取ることができる物質」というのはここからきているんです。
当然、「求電子性の強さ=酸性の強さ」が成り立ちます。
【求核反応を起こしやすい試薬】
先ほどとは逆に、「核を求める」→「電子密度が高い」試薬なので-イオン(δ-)やローンペアを持つ原子、化合物だということがイメージできます。
例えば
H-、OH-、RMgBr、H2O、ROH、RSH 、NH3
ここからは先ほどと同じ考え方です。
OH-やNH3が塩基性ということはみんな知っています。
つまり「求核反応を起こす試薬はその反応では塩基(ルイス塩基)として働く」ということがポイントです。
ルイス塩基の定義である「電子対を渡すことができる物質」というのはここからきています。
当然、「求核性の強さ=塩基性の強さ」が成り立ちます。
薬学部の進級・CBT・卒業試験・国家試験の個別指導家庭教師はこちら↓
https://fanblogs.jp/yakugaku594/archive/124/0?1462235527
2016年04月12日
有機化学の反応の基礎~反応の名前の付け方
今回は有機化学の反応が苦手な人向けの内容です。
皆さんは「求電子置換反応」や「求核付加反応」と聞いて、どういう反応かパッとイメージが沸きますか?
有機化学が苦手な方はこれらの反応の区別があいまいという方が多いです。
まず
「〇〇▢▢反応」とあったとき
〇〇は試薬がどういう反応をするかによって、求電子or求核
▢▢は基質が反応前後でどう変化しているかによって、置換or付加or脱離or転移
が入ります。
※〇〇と▢▢で基準となっているものが逆なので注意
(例えば求電子置換反応の場合、
試薬が基質の電子⊖を求めて反応し、その結果、基質の原子や置換基が別の原子や置換基に置き換わる反応を指す。)
【反応から判断する手順】
①基質と試薬でどちらが電子密度が高いか(=⊖が強いか)を比較する。
(1)試薬<基質の場合は試薬が基質の電子⊖を求めて反応するので求電子反応、
(2)試薬>基質の場合は試薬が基質の原子核⊕を求めて反応するので求核反応
②基質が反応前後でどう変化したかを比較する。
(1)基質の原子や置換基が、別の原子や置換基に置き換っていれば置換反応(ハロゲン化アルキル、芳香族など)
(2)基質の多重結合が1本切れて、新たに結合が生じていれば付加反応(アルケン/ケトン・アルデヒドなど)
(3)基質から2つの原子や置換基が脱離して、新たに多重結合が生じていれば脱離反応(ハロゲン化アルキル、アルコールなど)
(4)基質のある原子に結合していた原子や置換基が、別の原子に転移していれば転移反応(人名反応に多い)
【例:ベンゼンのニトロ化】
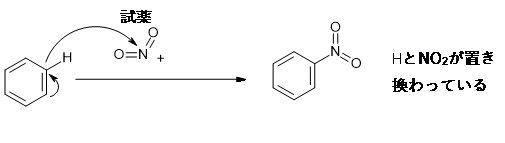
①電子密度は試薬<基質であるため、試薬がベンゼンの電子を求めて反応を起こすので求電子反応
②基質の反応前後を比較するとH原子がNO2と置き換わっているので置換反応
なので、つなげるとこの反応は「求電子置換反応」となります。
(ちなみに脱離反応と転移反応には、試薬が関わらず基質だけで起こる場合もあり、通常〇〇と繋げて呼ぶことはありません)
慣れてしまえば反応を見た瞬間に「これは〇〇▢▢反応だ」と判断できるようになります。
それまでは上の手順に沿って、反応を見たら一つ一つ分類していきましょう。
こうすることで、電子の動き(矢印)や反応性を考えるための土台が出来ていきます。
電子の動き(矢印)や反応性を自分で考えられるようになれる(=確かな基礎力が身についている)ようになれば、有機化学の反応を「なんとなく」とか「丸暗記」で覚えることから解放され、国試の考える問題にも対応出来るようになります。
有機化学は転移反応など一部の例外を除き、ほとんどが基本通りの反応であるため、確かな基礎力が身につけば化学の科目は国試の9科目の中でおそらく一番覚えることが少ない楽な科目ということに気が付くと思います。
さらに有機化学で身につけた基礎力は「物理や衛生の定性・定量法」の範囲や「衛生や動態の代謝」の範囲や「薬理の作用機序」など、薬学のあらゆるところを理解するときにそのまま使うことができるので非常に役に立ちます。
(僕の授業ではこの「有機化学の確かな基礎力」をその学生さんにとって最短距離で身につくように指導しています。)
次回は求電子反応を起こす試薬、求核反応を起こす試薬について補足していきます。
皆さんは「求電子置換反応」や「求核付加反応」と聞いて、どういう反応かパッとイメージが沸きますか?
有機化学が苦手な方はこれらの反応の区別があいまいという方が多いです。
まず
「〇〇▢▢反応」とあったとき
〇〇は試薬がどういう反応をするかによって、求電子or求核
▢▢は基質が反応前後でどう変化しているかによって、置換or付加or脱離or転移
が入ります。
※〇〇と▢▢で基準となっているものが逆なので注意
(例えば求電子置換反応の場合、
試薬が基質の電子⊖を求めて反応し、その結果、基質の原子や置換基が別の原子や置換基に置き換わる反応を指す。)
【反応から判断する手順】
①基質と試薬でどちらが電子密度が高いか(=⊖が強いか)を比較する。
(1)試薬<基質の場合は試薬が基質の電子⊖を求めて反応するので求電子反応、
(2)試薬>基質の場合は試薬が基質の原子核⊕を求めて反応するので求核反応
②基質が反応前後でどう変化したかを比較する。
(1)基質の原子や置換基が、別の原子や置換基に置き換っていれば置換反応(ハロゲン化アルキル、芳香族など)
(2)基質の多重結合が1本切れて、新たに結合が生じていれば付加反応(アルケン/ケトン・アルデヒドなど)
(3)基質から2つの原子や置換基が脱離して、新たに多重結合が生じていれば脱離反応(ハロゲン化アルキル、アルコールなど)
(4)基質のある原子に結合していた原子や置換基が、別の原子に転移していれば転移反応(人名反応に多い)
【例:ベンゼンのニトロ化】

①電子密度は試薬<基質であるため、試薬がベンゼンの電子を求めて反応を起こすので求電子反応
②基質の反応前後を比較するとH原子がNO2と置き換わっているので置換反応
なので、つなげるとこの反応は「求電子置換反応」となります。
(ちなみに脱離反応と転移反応には、試薬が関わらず基質だけで起こる場合もあり、通常〇〇と繋げて呼ぶことはありません)
慣れてしまえば反応を見た瞬間に「これは〇〇▢▢反応だ」と判断できるようになります。
それまでは上の手順に沿って、反応を見たら一つ一つ分類していきましょう。
こうすることで、電子の動き(矢印)や反応性を考えるための土台が出来ていきます。
電子の動き(矢印)や反応性を自分で考えられるようになれる(=確かな基礎力が身についている)ようになれば、有機化学の反応を「なんとなく」とか「丸暗記」で覚えることから解放され、国試の考える問題にも対応出来るようになります。
有機化学は転移反応など一部の例外を除き、ほとんどが基本通りの反応であるため、確かな基礎力が身につけば化学の科目は国試の9科目の中でおそらく一番覚えることが少ない楽な科目ということに気が付くと思います。
さらに有機化学で身につけた基礎力は「物理や衛生の定性・定量法」の範囲や「衛生や動態の代謝」の範囲や「薬理の作用機序」など、薬学のあらゆるところを理解するときにそのまま使うことができるので非常に役に立ちます。
(僕の授業ではこの「有機化学の確かな基礎力」をその学生さんにとって最短距離で身につくように指導しています。)
次回は求電子反応を起こす試薬、求核反応を起こす試薬について補足していきます。
